末期臓器不全患者に対する臓器移植及び、先天性免疫不全症候群ならびに血液悪性疾患等に対する骨髄移植が確立され、移植治療は臨床で不可欠な治療法となっている。現在の移植治療では、同種異系である臓器、細胞を使用するため、拒絶反応が生じる。そのため、この拒絶反応をコントロールするために免疫抑制剤が必要である。近年の免疫抑制剤開発により、より安全に、より選択的(移植反応の主要なエフェクター細胞はT細胞である)で効果の高い免疫抑制が可能となってきた。しかしながら、現在でもなお、その非特異的免疫抑制作用による重症感染症、悪性腫瘍の発生は、解決すべき大きな課題である。また、慢性拒絶反応による遅発性移植臓器不全のコントロールは、現在の免疫抑制剤では不可能であり、再移植に頼らざるを得ないが、それに伴う移植臓器不足は更に深刻化している。これらの問題を解決するには、ドナー抗原特異的な免疫応答のみを抑制する方法の確立が必要となる。究極的にはドナー特異的免疫寛容、つまり、レシピエントをドナーの抗原のみに対する免疫反応がおこらない状態に陥らせることが最善の方法である。
2. アロ免疫応答とアロ抗原
胸腺由来T細胞が存在しないヌードマウスは、同種異系皮膚を生着させることからもわかるように、生体内で移植急性拒絶反応を惹起する主要なエフェクター細胞は胸腺由来T細胞である。T細胞のアロ抗原に対する反応様式は大きく2つに分けられる。一つは、アロの主要組織適合抗原(MHC)を直接認識する反応で、direct
recognitionと呼ばれるものである。この反応は、一般の蛋白や病原体の抗原と比較すると、T細胞レセプターとの結合力(アフィニティー)が強く、かつ膨大な比率のレパートリー(その抗原に反応し得るT細胞の種類で、生体内の各T細胞特有のT細胞レセプターの種類を反映)が存在するため、非常に強い免疫応答が生じる。もう一つは、アロ抗原をレシピエントの抗原提示細胞(APC)が貪食し、それを自己MHCにアロ抗原由来ペプチドとして提示し、それをT細胞が認識する反応でindirect
recognitionと呼ばれている。この時のアロ抗原はマイナー抗原[例えば雄抗原(H-Y抗原)]と呼ばれる。MHCとマイナー抗原の違うドナー、レシピエントの組み合わせをfully
allogenic combinationという。一般に拒絶反応の強さは、ドナーとレシピエント間の相違する抗原量に依存し、その違いが多くなればなるほど拒絶反応を強く引き起こす。マウス皮膚移植モデルでの生着期間の差違でもわかるように、マイナー抗原のみの違う組み合わせとfully
allogenic combinationでの拒絶反応は後者が強い。マイナー抗原のみの違いでも、H-Y抗原のみ違う場合と更に遺伝的隔絶が多岐にわたる組み合わせの場合は、後者の方が拒絶反応が強い。ヒトにおいても同様で、移植まで比較的有余期間のあるヒトの腎、骨髄移植では、MHCを合わせたマイナー抗原のみの違うドナー、レシピエントの組み合わせが移植成績が良好なため、なるべくMHCの合ったドナーが選択される。肝、心、肺移植については、緊急を要することが多く、特にドナーのMHCは合致させていない。しかし、予想されるとうり、心、肺移植において、拒絶反応による臓器不全はHLAが合致した方が少ないと報告されている。この拒絶反応の強さの相違は反応制御を目指す上で、非常に重要であると考えている。
3. 拒絶反応の臓器(細胞)特異性
動物モデルにおいて示されているように、拒絶反応の感受性が各臓器ごとにかなりの違いがある。例えば、マウスのfully allogenic
combinationにおいて、皮膚移植片は7-10日で確実に拒絶されるが、移植肝グラフトは、一過性に拒絶反応を起こすものの、免疫抑制剤なしでほとんどの組み合わせで生着する。また、T細胞応答の後に出現するドナー抗原に対する抗体の感受性も各臓器によって違っており、皮膚移植では抗体の感受性は低く、心臓、腎臓等では比較的感受性が高い。肝臓ではMHCに対する抗体が被覆抗体として働き、T細胞応答の低下に寄与しているとの報告もある。骨髄細胞に関しては現在まで一定の見解は得られていなかったが、我々の行ったマウス骨髄移植モデルの実験結果より、通常の骨髄細胞投与量においては、抗体の存在と骨髄細胞の生着には差違がないということが判明した(永田ら、未発表データ)。
この拒絶反応の臓器(細胞)特異性については、ヒトの臓器移植でも認められる。例えば、優れた免疫抑制剤の開発、各臓器に最適の免疫抑制プロトコールの開発に伴い、現在では、肺、腎、肝、心移植の急性拒絶反応のコントロールは比較的良好となってきた。しかし、小腸移植の場合、現在でもなお、そのコントロールは困難で、急性拒絶反応による移植臓器不全が高率に認められる。また、前者の臓器移植においても、遅発性の拒絶反応であるBronchiolitis
Obliterans(BO)、Chronic allograft nephropathy (CAN)、vanishing bile
duct syndrome、Transplant-related coronary-arterial disease (TRCAD)といわれる慢性拒絶反応は各臓器で異なった病態を示し、これらに対しては現在の免疫抑制剤は無効で、最終的に移植臓器不全に至る。以上のように種々の臓器ごとに拒絶反応の表現型、反応形態は相違があり、特に免疫応答以外(虚血再潅流障害、薬剤の感受性等)の因子の影響を受ける慢性拒絶反応における病態解析は諸臓器ごとに検討していく必要がある。
4. 拒絶反応の制御
拒絶反応を制御するアプローチとしては、移植臓器の拒絶反応を局所でコントロールする方法と全身の拒絶応答そのものを制御する方法がある。現在使用されている免疫抑制剤は後者にあたる。全身性にコントロールする場合、拒絶反応を引き起こす免疫応答そのものを抑制できるため、根本的な治療となりうるが、慢性拒絶反応などの移植臓器局所での因子が強く作用するものに対しては、局所への効果が制限される。また、その方法が抗原に非特異的な方法であればあるほど、感染などの副作用の問題が生じてくる。一方、移植臓器局所での拒絶反応制御の場合、より全身の副作用を軽減しつつ、効率の良い効果が得られる可能性があり、慢性拒絶反応で見られる血管内皮、血管壁平滑筋の肥厚、増殖や、線維芽細胞増殖による細気管支閉塞等の様に、免疫応答後の免疫反応以外の因子で増悪していく病態等には、局所治療が理想的である。しかし、免疫応答そのものを局所治療で制御した場合は、根本的な全身の抗原に対する免疫応答は抑制されていないため、非特異的な免疫応答を刺激される現象が移植臓器で発生した場合、その効果が十分に発揮できない可能性がある。
i) 移植臓器局所での免疫応答制御
肺移植の場合、急性拒絶反応は比較的少なく、慢性拒絶反応、すなわち、慢性閉塞性細気管支炎(Bronchiolitis Obliterans:
BO)が問題となっている。我々は、マウス異所性気管移植モデルを用いて、気管上皮に効率良く遺伝子導入ができるSendai virus
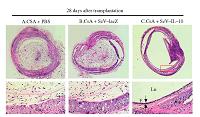
vector(SeV)に種々の免疫抑制作用をもつIL-10を搭載(SeV-IL10)し、その治療効果について、検討した(文献1)(図1)。
fully allogenic combinationにおける移植気管へSeV-IL10を用いてIL-10を遺伝子導入したところ、血中IL-10濃度を上昇させることなく、気管の閉塞をSeV-IL-10の投与量依存性に抑制することができた。SeVは搭載遺伝子を気道上皮に効率よく遺伝子導入することができるため、気管移植モデルで効率の良い慢性拒絶反応の抑制が可能であったと考えられる。また、IL-10は線維芽細胞の増殖抑制効果も持っており、免疫応答の後に起こる気管閉塞の原因となる線維芽細胞の増殖抑制にも効果があり、その相乗効果によるものと考えている。
ii) ドナー特異的免疫寛容の誘導
全身性に拒絶反応を抑制する場合、一般的に拒絶反応の強いものが、制御困難である。前述のようなドナーとレシピエント間の遺伝的隔絶に比例する拒絶反応についても、その強さにより制御の困難度に相違がある。例えば、マウス皮膚移植モデルで、DST (donor
specific transfusion:ドナーリンパ球の静脈投与による免疫応答制御法)は、H-Y抗原のみの違う組み合わせではドナー特異的免疫寛容を誘導できる(文献2)が、マイナー抗原が多岐にわたるC3H、AKR間(両者ともMHCはH-2k)では寛容を誘導することができない。さらに、C3H、AKR間の寛容を誘導できるサイクロフォスファミド(CP)誘導性免疫寛容システムの原法(ドナーリンパ球細胞を静脈注射し、その2日後にCPを投与するという簡単な寛容誘導法)はfully
allogenic combinationの寛容誘導は不可能である。近年、富田らによって、CP誘導性免疫寛容システムの原法をmodifyし、CP、ブスルファンと脾細胞及び骨髄細胞を用い、ドナー細胞のキメラ状態を作成することにより、fully
allogenic combinationにおいても免疫寛容を誘導できることが報告された(文献3)。
また、臓器ごとに拒絶反応の強さに相違があることは前述のとうりだが、免疫制御の難易度も、各臓器によって異なる。移植臓器の中で、肝臓は比較的生着しやすい臓器といわれているが、我々は、生体防御医学研究所、野本研究室との共同研究により、fully
allogenic combinationでのラット皮膚移植モデルでは皮膚を生着させることは不可能であるCP誘導性免疫寛容システムの原法が、ラット肝移植急性拒絶モデルでは、完全にドナー肝臓を長期生着させ、ドナー特異的免疫寛容にさせることを報告した(文献4)。ヒトの免疫抑制剤の使用法でも肝移植では、steroidとcalcineurin
inhibitorの2剤がスタンダードであるが、腎移植の場合それに加え、mycophenolate mofetilなどのpurine and
pyrimidine biosynthesis inhibitorsを加える3剤投与がスタンダードであることをみても臓器によりその拒絶反応制御の難易度の違いがあることが分かる。
このように、ドナーとレシピエントの遺伝的隔壁はその反応を制御する上で、非常に重要な因子となり、特に遺伝的隔絶の多岐にわたるヒトの移植治療において、アロ抗原の反応は一様でなく、さまざまな抗原に対する反応の総和が拒絶反応という病態を形成していると考えられるため、動物モデルで開発された方法を臨床応用する場合、種々のstrain
combinationで確実な効果を得られる方法が必要であると考えている。また、拒絶反応の臓器特異性を考慮に入れ、その臓器に合った、ドナー特異的抗原の拒絶反応制御方法(e.g.
肝臓の免疫寛容源性を損なわない様な方法)を検討することが、安全で効率の良い方法の開発に寄与するものと考えている。
5. 今後の展望
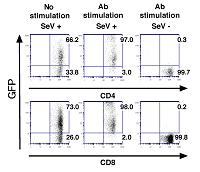
現在まで実験的には種々の寛容誘導システムが開発されているものの、実際に臨床への応用がなされているものはほとんどない。一つの理由として、腎移植初期に使用されていた全身放射線照射等という副作用の強いプロトコールを使用しなくとも、短期的には、ほとんどの移植臓器の急性拒絶反応のコントロールが比較的良好となってきたためと考えられる。つまり、過量の薬剤、放射線照射、T細胞応答を広範に抑制するプロトコールで導入する免疫寛容導入は、現在の免疫抑制法より、導入時期の副作用が懸念されるのである。しかしながら、現在の免疫抑制剤でコントロールできない急性拒絶反応(subclinicalな急性拒絶反応を含む)や、薬剤による耐糖能異常や高血圧といった副作用が慢性拒絶反応の一因とされていることを考慮すると、ドナー特異的免疫寛容法の確立は10年以上の長期の移植臓器の生着率の改善に寄与するものと考えられる。安全性の面で、現在の免疫抑制剤に匹敵する寛容導入の実現のためには、導入時点からのドナー抗原特異的免疫応答抑制プロトコールの開発が望まれる。我々は、これまでのベクターと比較し、SeVはアロ抗原特異的活性化T細胞へ簡単に効率よく遺伝子導入できることを報告している(文献5)(図2)。このベクターを用い、抗原特異的T細胞に効率良く遺伝子導入し、in
vivo(リンパ節、脾臓、移植臓器)で起こる免疫応答を抗原特異的に抑制できれば、導入期にも抗原特異的な免疫寛容導入法を確立できる可能性があると考えている。
Nagata S, Okano S, Yonemitsu Y, Yoshida K, Nagata H, Nakagawa K, Tomita Y, Yoshikai Y, Shimada M, Maehara Y, Sueishi K. Transplantation 82(5):689-98. 2006.
2. Airway-directed gene transfer of interleukin-10 using recombinant Sendai virus.
Shoji F, Yonemitsu Y, Okano S, Yoshino I, Nakagawa K, Nakashima Y, Hasegawa M, Sugimachi K, Sueishi K.
Gene Therapy. 10; 213-218, 2003.
3. Role of Fas-Fas ligand interaction in donor-specific transfusion-induced tolerance to H-Y antigen.
Minagawa R, Okano S, Tomita Y, Shimizu I, Iwai T, Kishihara K, Nomoto K, Sugimachi K, Nomoto K.
Transplant Proc. 33; 283, 2001.
4. Induction of permanent mixed chimerism and skin allograft tolerance across fully
MHC-mismatched barriers by the additional myelosuppressive treatments in mice
primed with allogeneic spleen cells followed by cyclophosphamide.
Tomita Y, Yoshikawa M, Zhang QW, Shimizu I, Okano S, Iwai T, Yasui H,
Nomoto K.
J Immunol. 165; 34-41, 2000.
5. Cyclophosphamide-induced tolerance in rat orthotopic liver transplantation.
Okano S, Eto M, Tomita Y, Yoshizumi T, Yamada H, Minagawa R, Nomoto K, Sugimachi K, Nomoto K.
Transplantation. 71; 447-56, 2001.
6. Recombinant Sendai virus vectors for activated T-lymphocytes.
Okano S, Yonemitsu Y, Nagata S, Sata S, Onimaru M, Nakagawa K, Tomita Y, Kishihara K, Hashimoto S, Nakashima Y, Sugimachi K, Hasegawa M, Sueishi K,
Gene Therapy 10: 1381-1391, 2003