2023.06.08
「発達期における神経突起の刈り込みを制御するシナプス競合の基本原理を解明 」(疾患情報研究分野 今井 猛 教授)
― 雑多な入力を遮断し、精緻な回路をつくるための仕組み ―
- ① 生後発達の過程では一旦過剰に作られた神経回路が再編成されることで精緻な回路が作られ
ますが、再編成の過程でどのようにして刈り込むべき神経突起が決まるのかは長年の謎でした。 - ② シナプスに入力があると、そのシナプスを保護しつつ、それ以外のシナプスの刈り込みを促進
する「側方抑制」という仕組みが働くことが分かりました。 - ③ シナプス除去は発達期に脳の至るところで起こっており、精神疾患との関連も知られているこ
とから、こうした疾患のメカニズムの解明にもつながることが期待されます。
概要
九州大学大学院医学研究院の今井猛教授、藤本聡志助教、マーカス・ルーウィ助教(研究当時)、藍原周平大学院生(研究当時)、千葉大学大学院医学研究院の斎藤哲一郎教授らの研究グループは、発達期に神経細胞の樹状突起刈り込みを制御する「シナプス競合」のメカニズムを明らかにしました。
哺乳類の神経回路では、発達初期に回路接続(シナプス)が過剰につくられますが、その後、シナプスからの入力に応じてそれらが再編成されることで精緻な回路が作られます。再編成の過程では、必要な神経突起やシナプスを作ったり強化したりするだけでなく、不要なものを除去することが重要です。例えば、マウス嗅球の僧帽細胞は、発達初期には複数の樹状突起を伸ばしており、複数の嗅覚受容体(においセンサー)からの情報が混ざって入力されますが、やがて樹状突起を刈り込んで 1 本だけにするため、最終的には単一の嗅覚受容体の情報だけを受け取るようになります。シナプス除去は異なるシナプスが互いに競合することで生じると考えられてきましたが、どのようして競合し、勝者と敗者が決まるのかは長らく不明でした。本研究は、僧帽細胞をモデルとして研究を行い、僧帽細胞の樹状突起刈り込みには自発神経活動によって放出されるグルタミン酸の入力が必要であることを見出しました。グルタミン酸は樹状突起の NMDA 受容体を活性化したのち、刈り込み分子である RhoA の活性を局所的に低下させる一方で、神経細胞全体にわたって RhoA を活性化させ、残りの樹状突起の刈り込みを促進することを明らかにしました。すなわち、RhoA の制御によって、入力を受けたシナプスのみを保護し、それ以外のシナプスを弱めるという、「側方抑制」の仕組みが働いていることが分かりました(図1)。RhoA は触覚に関わる大脳皮質のバレル皮質 4層の神経細胞の樹状突起刈り込みにおいても必須であることがわかり、神経回路の再編成において普遍的なメカニズムであることが示唆されました。シナプス除去は発達期に脳の至るところで起こることが知られており、その異常は様々な精神疾患に関わることが示唆されています。本成果はこうした疾患のメカニズムの理解にも貢献するものです。
本研究は JST さきがけ、CREST、日本医療研究開発機構(AMED)、日本学術振興会(JSPS)科学研究費補助金、三菱財団、住友財団、中島記念国際交流財団、持田記念医学薬学振興財団、上原記念生命科学財団の助成によって行われました。本成果は、令和 5 年 6 月 7 日(水) (米国時間午前 11 時)に米国の科学雑誌『Developmental Cell』に掲載されました。本研究は千葉大学、関西医科大学との共同研究として、九州大学および理化学研究所多細胞システム形成研究センター(研究当時)にて実施されました。
研究者からひとこと: 本研究成果は 10 年以上
にわたる地道な研究の産物です。回路が作られ
る仕組みの研究はたくさんありましたが、回路
を除去する仕組みについては、今回はじめてそ
の基本原理を明らかにできたと考えています。

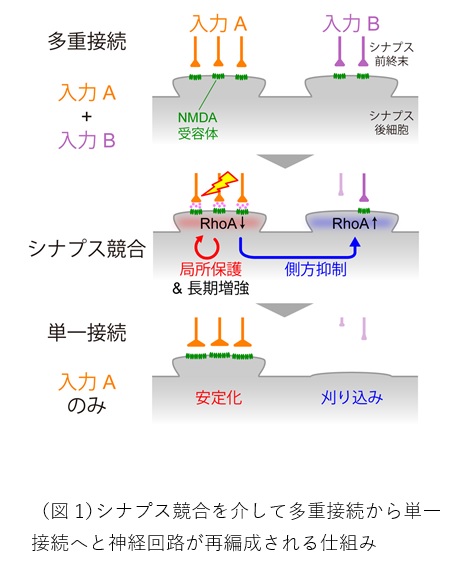
私たちは外界からの多様な情報を感覚器官で受け取り、その情報を脳に伝達し処理することにより行動へとつなげることができます。この情報伝達を担う神経細胞は、情報を受け取る樹状突起と情報を次の神経細胞へ伝達する軸索を持っています。適切な情報処理を行うためには、樹状突起と軸索が適切な接続相手とのみシナプスを形成することが重要です。しかし、私たちの脳は生まれながらにしてこのような精緻な神経回路を持っているわけではありません。発達期には、神経細胞は一旦過剰なシナプスを形成するため、個々の神経細胞は雑多な入力を受けることになります。その後、一度作られた神経回路を「再編成」することで、個々の神経細胞は特定の感覚入力(受容野という)だけを受けることができるようになります。
神経回路の再編成の過程においては、必要なシナプスを強化するだけでなく、不必要なシナプスを刈り込み、ノイズを除去することが重要です。古くから、この過程にはシナプス入力と神経活動(いわゆる神経細胞の「発火」)が重要な役割を果たすことがよく知られてきました。シナプスを強化する仕組みについてはすでによく研究されており、1949 年にドナルド・ヘブが提唱したヘブ則(※1)に基づいて説明されています。これは、シナプス入力と同時に神経細胞が活動(発火)すると、そのシナプスが強化されるという法則で、メカニズムの詳細もよく分かっています。逆に、入力が弱く、神経細胞が同時に活動しない場合にはそのシナプスは除去されますが、その仕組みについてはよくわかっていませんでした。異なる入力を受けるシナプスの間で競合が起こり、強くて必要なシナプスのみが「勝者」として残る一方、それ以外が「敗者」として刈り込まれるという「シナプス競合」という現象があると提唱されてきましたが、どのようなメカニズムによってシナプス間の競合が起こるのかについては、数 10年来の大きな謎でした。
この謎に挑むため、本研究ではマウス嗅球の僧帽細胞に着目しました。僧帽細胞は、発達過程の初期には複数の樹状突起を複数の「糸球体」という構造に伸ばしており、複数の嗅覚受容体(匂いセンサー)からの情報が混線したまま入力されます。しかしながら、僧帽細胞はやがて樹状突起の刈り込みを行い、最終的には 1 本の樹状突起のみを 1 つの糸球体にのみ接続し、そこで1種類の嗅覚受容体の情報のみを受け取るようになります(受容野が精緻になる)。この刈り込みの結果と、僧帽細胞では匂い情報が混線することなく識別できるようになるのです(図2)。研究グループはこの僧帽細胞の樹状突起刈り込みをモデルとして、シナプス競合のメカニズムを調べました。
まず、僧帽細胞の樹状突起刈り込みにも神経活動が必要かどうか調べるため、子宮内電気穿孔法(※ 2)を用いて僧帽細胞に Kir2.1(※3)を過剰発現させ、僧帽細胞の神経活動を人為的に抑制しました。 その結果、樹状突起が刈り込まれなくなることが判明しました(図3)。次に、樹状突起の刈り込みに 必要なシナプス入力がどこからやってくるのかを調べました。これまでの研究では、少なくとも鼻腔か ら脳の嗅球へと情報を伝達する嗅神経細胞からの入力は僧帽細胞の樹状突起刈り込みに必要ないこと が示されていました。そこで、嗅神経細胞からではなく、嗅球内の自発的な神経活動に基づく入力が関 わっている可能性を検討しました。僧帽細胞に GCaMP(カルシウムセンサー)を発現する遺伝子改変 マウスを用いてカルシウムイメージング(※4)を行うと、新生仔期には僧帽細胞の自発的な神経活動 が観察されました。さらに、単離した嗅球においても同様の自発神経活動が観察されたことから、この 活動は、嗅球内で生み出されていることがわかりました。この単離した嗅球のサンプルに対して薬剤の 効果を調べる実験を行ったところ、自発神経活動にはグルタミン酸が関わっていることがわかりました。 また、僧帽・房飾細胞に破傷風毒素軽鎖(※5)を発現する遺伝子改変マウスを用いて僧帽・房飾細胞 からのグルタミン酸の放出を遮断しました。すると、自発神経活動は減少し、樹状突起の刈り込みも阻 害されました。以上のことから、僧帽・房飾細胞どうしがグルタミン酸を放出し合うことで、自発的な 神経活動が生じ、刈り込みが起こっていることが明らかとなりました(図4)。
次に、シナプスにおけるグルタミン酸の入力がどのようにして樹状突起の刈り込みを引き起こすのか を検討しました。グルタミン酸を受け取る NMDA 受容体の役割について調べるため、NMDA 受容体の 必須サブユニットである GluN1 を僧帽細胞特異的に欠損させたところ、樹状突起の刈り込みが阻害され ました。そこで、NMDA 受容体の下流で刈り込みを制御する分子群の探索を行いました。神経突起の退 縮に関わる Rho サブファミリー遺伝子群(RhoA, RhoB, RhoC)(※6)を CRISPR-Cas9(※7)法を 用いて全て欠損させると樹状突起の刈り込みが阻害されることを見出しました。また GluN1 を欠損した 僧帽細胞に RhoA を過剰発現させると刈り込み異常が正常に戻りました。これらの結果から、NMDA 受 容体を介して、刈り込み分子である RhoA を活性化させることが樹状突起の刈り込みにつながることが 明らかとなりました(図5)。
しかし、1 本の樹状突起のみを「勝者」として残し、それ以外の樹状突起を刈り込むためには RhoA の活性化は「敗者」となるべき樹状突起でのみ起こる必要があります。その仕組みを明らかにするため、 RhoA のセンサーを用いた FRET イメージング(※8)を行い、NMDA 受容体が活性化された際の RhoA 活性の時空間パターンの解析を行いました。嗅球スライスを NMDA 受容体だけ選択的に活性化できる 薬剤 NMDA(※9)で刺激すると、僧帽細胞の多くの部分では RhoA の活性上昇が見られましたが、シ ナプスが最も豊富な樹状突起の先端では逆に RhoA 活性が低下することが判明しました。一方、高濃度 カリウム溶液を用いて、僧帽細胞全体を脱分極(※10)させた場合には、樹状突起の先端部を含む僧 帽細胞全体で RhoA が活性化しました。これらの結果から、NMDA 受容体が活性化されると、その近傍 では局所的に RhoA の活性を抑制されるが、引き続いて神経細胞が脱分極すると、神経細胞全体で RhoA が活性化され、保護されていない「敗者」の樹状突起の刈り込みが促進される、という可能性が考えら れました(図6)。
この可能性をより直接的に証明するために、複数ある樹状突起の 1 つで NMDA 受容体を活性化した 際にそれ以外の樹状突起で RhoA の活性がどのように変化するのかを FRET イメージングによって検討 しました。まず、枝分かれが多くてシナプスが豊富な樹状突起とシナプスが少ししかない樹状突起の両 者を持つ僧帽細胞のみに着目して解析を行いました。このタイプの僧帽細胞では、NMDA 刺激を行うこ とで、シナプスが豊富な樹状突起の NMDA 受容体を選択的に活性化することが可能です。これらの細 胞に対して NMDA 刺激を行うと、RhoA の活性はシナプスの豊富な樹状突起で低下する一方、それ以外 の樹状突起では上昇することが観察されました(図 7A)。対照的に、シナプスの豊富な樹状突起を 2 本 持つ僧帽細胞において同様の実験を行うと、どちらの樹状突起においても RhoA の活性低下が見られま した(図 7B)。これらの結果から、RhoA の活性制御の役割について、以下のようなことが考えられま す。樹状突起において強いグルタミン酸入力が入ると、NMDA 受容体が活性化され、RhoA が局所的に 抑制されることで刈り込みに対する保護機構が働きます。一方、引き続いて生じる脱分極によって、僧 帽細胞全体で RhoA が活性化され、保護されていない樹状突起の刈り込みが促進されます。このように、 RhoA はシナプス入力を直接受けたシナプス「以外」を刈り込む「側方抑制シグナル」として作用して いると考えられます。従って、複数の樹状突起間でシナプス入力の程度に違いがあると、お互いを抑制 し合う結果、強い者はますます強く、弱い者はますます弱くなり、最終的に 1 本の樹状突起のみが「勝 者」として残ることになると考えられます(図8)。
最後に、この RhoA を介した側方抑制の仕組みが僧帽細胞以外の神経細胞の樹状突起再編成にも関与 しているのかを検討しました。マウス大脳皮質の感覚野にはヒゲ 1 本 1 本の触覚情報に特化したバレル と呼ばれる構造が存在します。そこに存在する 4 層ニューロンは、はじめは雑多な入力を受けています が、発達期の樹状突起刈り込みを経て、1 本のヒゲからの触覚情報のみを受け取るようになります。こ れまでに GluN1 を欠損させると刈り込みが起こらなくなり、1 本のヒゲ以外の触覚入力が混線すること が知られていました。本研究では、この 4 層ニューロンにおいて Rho サブファミリー遺伝子群を欠損さ せると、僧帽細胞と同様に樹状突起の刈り込みが起こらなくなることが判明しました。NMDA 受容体と RhoA シグナルが働かないと、樹状突起間の側方抑制シグナルを生じることができないため、特定のヒ ゲの入力以外の入力を受ける樹状突起も残ったままになってしまうと考えられます(図9)。
本研究により、NMDA 受容体と RhoA シグナルに基づくシナプス・神経突起の「局所的な保護」と「側方抑制」の仕組みがシナプス競合の分子実体であることが明らかとなりました。これまで、正しい回路が「作られる」仕組みは多く研究されてきましたが、不要な回路の「刈り込み」の原理は長年の謎でした。発達期のシナプス再編成は脳のいたるところで起こっており、本研究で明らかとなったRhoA を介したシナプス競合と神経突起の刈り込み機構は、神経回路再編成における普遍的な原理であると考えられます。また、ヒトにおいてはシナプスの刈り込みが適切に行われないことが、神経疾患の原因となることが示唆されており、そうした疾患の発症メカニズムの理解にも貢献することが期待されます。
本研究は JST さきがけ「脳神経回路の形成・動作と制御」、CREST「多細胞間での時空間的相互作用の理解を目指した定量的解析基盤の創出」、日本医療研究開発機構(AMED)「革新的技術による脳機能ネットワークの全容解明プロジェクト」「脳とこころの研究推進プログラム(領域横断的かつ萌芽的脳研究プロジェクト)」、科学研究費補助金、新学術領域研究「スクラップ&ビルドによる脳機能の動的制御」「マルチスケール精神病態の構成的理解」、学術変革領域「脳の若返りによる生涯可塑性誘導-Plasticity臨界期機構の解明と操作」、三菱財団、住友財団、中島記念国際交流財団、持田記念医学薬学振興財団、上原記念生命科学財団の助成によって行われました。本成果は、令和 5 年 6 月 7 日(水) (米国時間午前11 時)に米国の科学雑誌『Developmental Cell』に掲載される予定です。本研究は千葉大学、関西医科大学との共同研究として、九州大学および理化学研究所多細胞システム形成研究センター(研究当時)にて実施されました。
同期した強い発火をする神経細胞間のシナプスは強化されるというシナプス可塑性の法則。つまり、シ ナプス入力と同時に神経細胞が発火すると、そのシナプスは強化される。ドナルド・ヘッブによって提 唱された。
マウス胎仔の脳室内にプラスミド DNA を注入し、電気パルスをかけることで遺伝子導入を行う手法。 本研究では、この方法を用いて僧帽細胞の遺伝学的操作を行った。
内向き整流カリウムチャネル。過剰に発現させると、神経細胞が過分極し発火しにくくなるため、神経 活動を抑制するための遺伝学的ツールとして用いられる。
カルシウムに結合すると蛍光を発するセンサー(本研究においては GCaMP)を用いて、細胞内のカル シウムの濃度を蛍光顕微鏡で観察できる。神経細胞においては、神経活動によって細胞内カルシウム濃 度が上がることが知られているため、神経活動を観察する方法として広く用いられている。
シナプス前膜から神経伝達物質が放出される際に必須な VAMP2 というタンパク質を切断する。このた め、破傷風毒素軽鎖を発現する神経細胞からは神経伝達物質の放出が抑制される。
Rho ファミリー低分子量 G タンパク質は GTP に結合し活性を持つ細胞内シグナルタンパク質である。 細胞内で分子スイッチとして働き、主に細胞骨格を制御することが知られている。そのうち Rho サブフ ァミリーとして RhoA、RhoB、RhoC の 3 種類が存在する。神経細胞においては神経突起を退縮させる 機能を持つことが知られている。
元々は細菌の免疫機構として発見された。細菌はウイルスが侵入してきた時に、ウイルス遺伝子の一部 を自身のゲノム(CRISPR 領域)に保存する。2 回目のウイルス侵入時は保存されたウイルス遺伝子の 配列を使うことで、ウイルス遺伝子を外部からの侵入者として認識。Cas9 タンパクによりそのウイル ス遺伝子を切断することで、ウイルスの増殖を防ぐ。狙った遺伝子を特異的に切断する能力を利用して、 近年は遺伝子編集ツールとして利用されている。
特定の 2 種類の蛍光分子が近傍にある状態で短波長側の蛍光分子の励起光を当てると、励起されたエネ ルギーが長波長側の蛍光分子に移動し、長波長側の励起光が放出される現象を FRET(Förster Resonance Energy Transfer、フェルスター共鳴エネルギー移動)と呼ぶ。一般的に、タンパク質の活 性変化には構造変化を伴うため、構造的に近づいたり離れたりする位置に蛍光タンパク質を結合させて おく(FRET センサー)と、活性の変化を FRET シグナルとして検出することができる。本研究では RhoA の活性化を計測するために利用した。
N-メチル-D-アスパラギン酸の略称。NMDA 型グルタミン酸受容体に対して選択的に作用し、活性化す ることができる薬剤。
神経細胞内外のイオン濃度が変化することで細胞膜の電位が上昇し、神経細胞が興奮すること。
タイトル:Activity-dependent local protection and lateral inhibition control synaptic competition in developing mitral cells in mice
(神経活動依存的な局所保護と側方抑制が発達期のマウス僧帽細胞においてシナプス競合を制御する)
著者:藤本聡志、マーカス・ルーウィ、藍原周平、坂口理智、室山優子、小早川令子、小早川高、斎藤哲一郎、今井猛
掲載誌:Developmental Cell
DOI:https://doi.org/10.1016/j.devcel.2023.05.004
九州大学大学院医学研究院 教授 今井 猛(イマイ タケシ)
TEL:092-642-6048 FAX:092-642-6923
Mail: imai.takeshi.457★m.kyushu-u.ac.jp
※★→@に置き換えてメールをご送信ください。
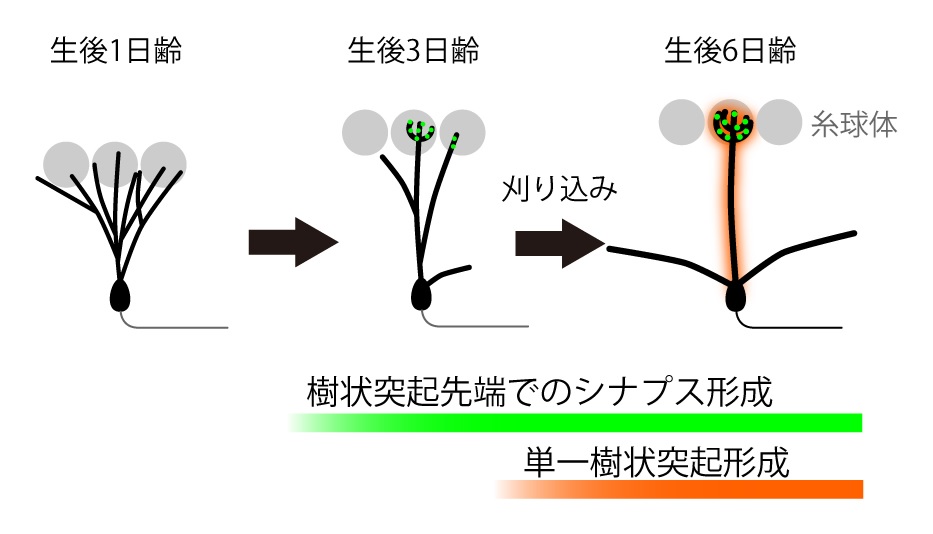 (図2) 発達期の僧帽細胞における単一樹状突起形成過程
(図2) 発達期の僧帽細胞における単一樹状突起形成過程僧帽細胞は生後1日齢では複数の樹状突起を複数の糸球体へと伸ばしている。生後3日齢頃に糸球体内の樹状突起で枝分かれや興奮性シナプスを形成した後、選択的な刈り込みを介して生後6日齢までに単一の樹状突起を形成する。これにより1種類の嗅覚受容体(匂いセンサー)の情報のみを受け取ることができ、これが匂い識別の基礎となっている。
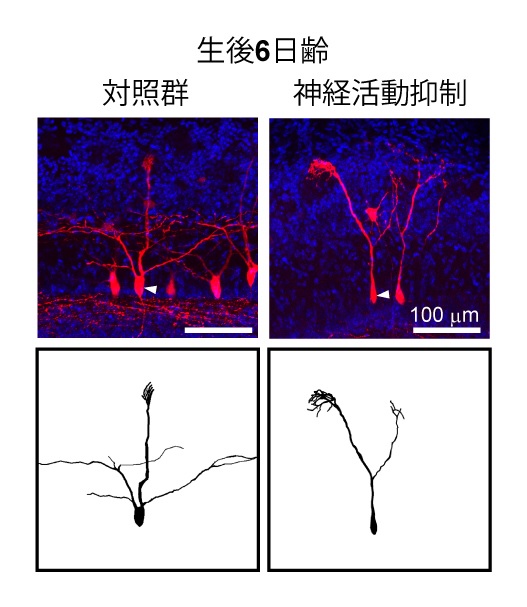 (図3)神経活動を抑制した僧帽細胞の樹状突起形成
(図3)神経活動を抑制した僧帽細胞の樹状突起形成僧帽細胞にKir2.1を過剰発現し神経活動を抑制すると樹状突起の刈り込みが起こらなくなり、複数の糸球体へ接続したままになる。
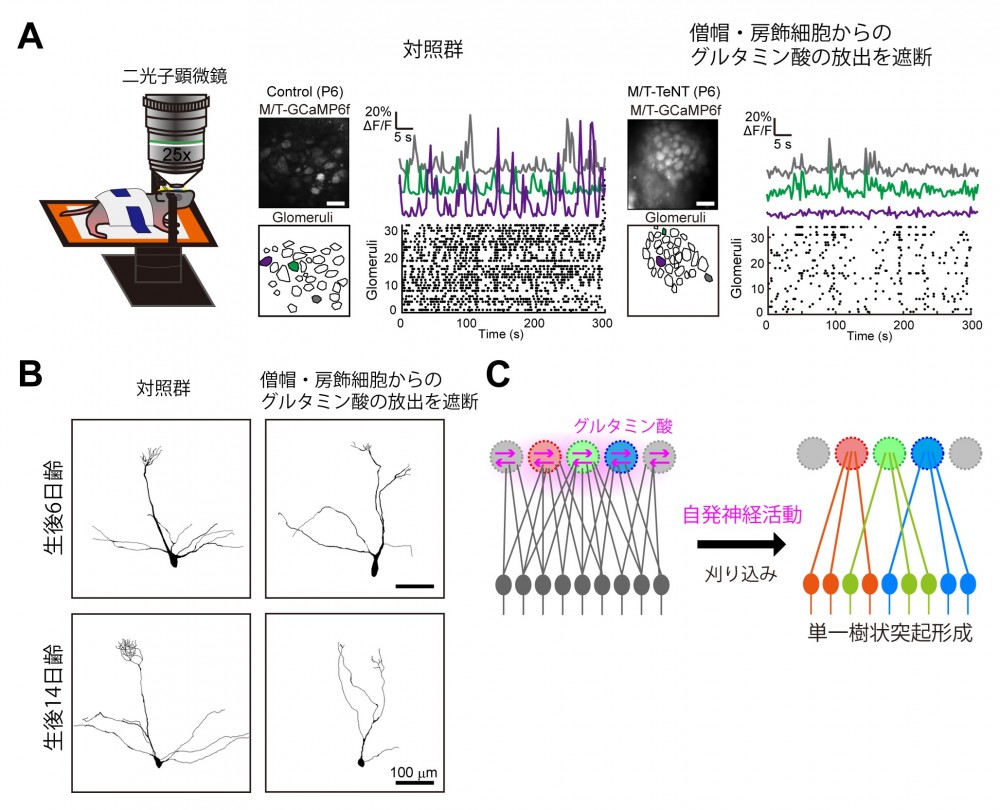 (図4) 自発神経活動による単一樹状突起形成
(図4) 自発神経活動による単一樹状突起形成(A)僧帽細胞にカルシウムセンサーを発現したマウスを二光子顕微鏡下で観察すると、対照群においては自発神経活動がみられる。しかし、僧帽・房飾細胞からのグルタミン酸の放出を遮断したマウスでは自発神経活動の頻度が減少し、振幅も減少する。(B)僧帽・房飾細胞空のグルタミン酸の放出を遮断したマウスでは刈り込みも起こらなくなる。(C)僧帽・房飾細胞どうしのグルタミン酸のやり取りによる自発神経活動が僧帽細胞の単一樹状突起形成に必要である。
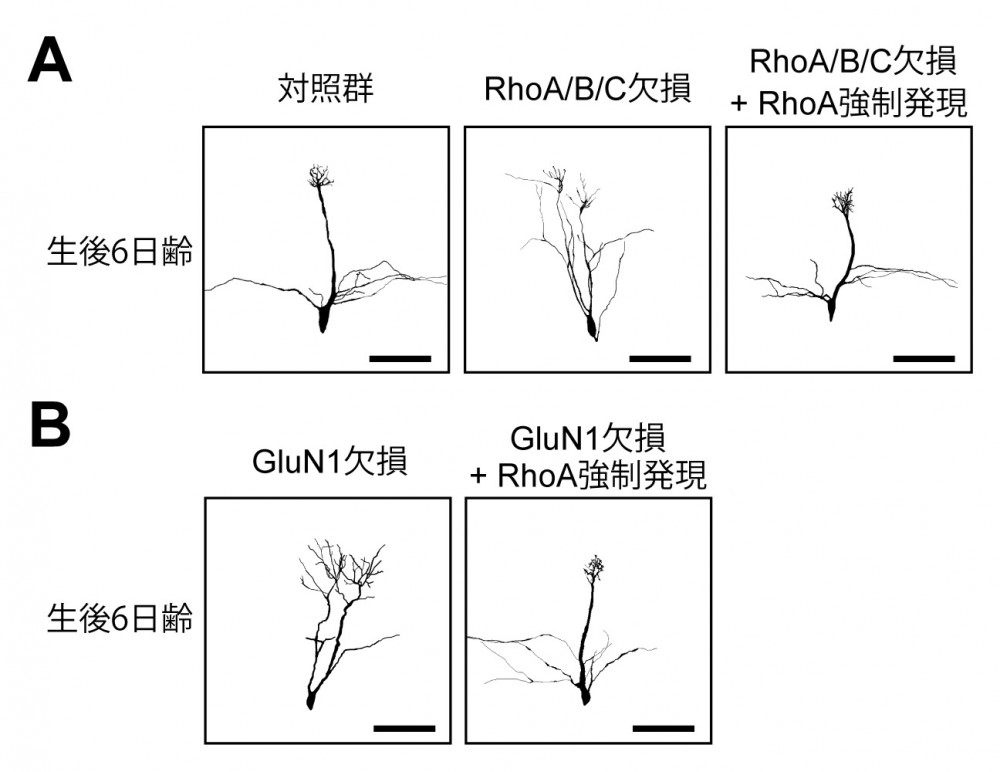 (図5) 刈り込みを制御する分子の探索
(図5) 刈り込みを制御する分子の探索(A) Rhoサブファミリー遺伝子群を欠損した僧帽細胞では刈り込みが起こらなくなる。(B) GluN1を欠損した僧帽細胞でも刈り込みが起こらなくなるがRhoAを強制発現させることで刈り込み異常が回復する。
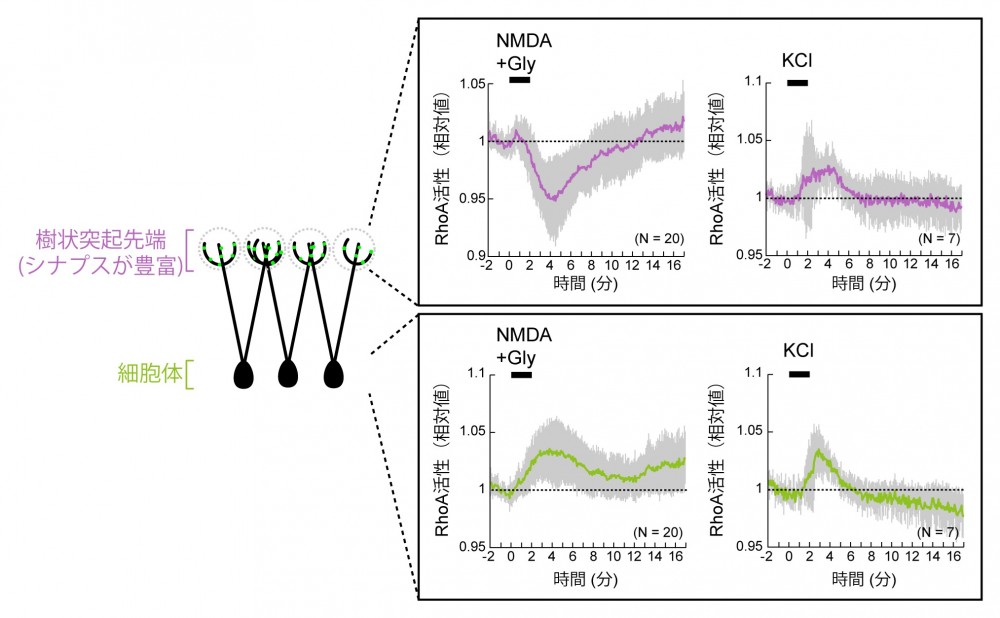 (図6) NMDA刺激によるRhoAの時空間的な活性制御
(図6) NMDA刺激によるRhoAの時空間的な活性制御NMDA刺激を行うと、シナプスの豊富な樹状突起先端では局所的にRhoAの活性が低下し、細胞体ではRhoAの活性が上昇する。KClによる脱分極刺激では細胞全体でRhoAの活性は上昇する。
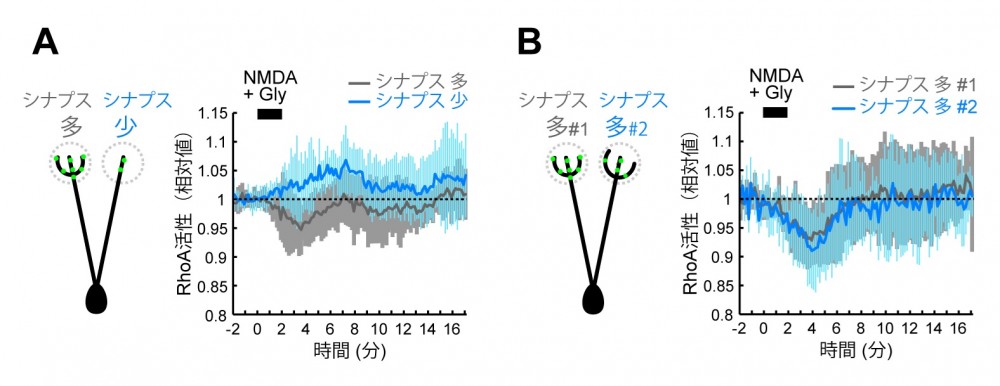 (図7) シナプスの豊富な樹状突起とシナプスのない樹状突起でのRhoA活性の違い
(図7) シナプスの豊富な樹状突起とシナプスのない樹状突起でのRhoA活性の違い(A)シナプスが豊富に存在する樹状突起のみをNMDAで刺激すると、RhoAはシナプスが豊富な樹状突起では活性が低下し、シナプスの少ない樹状突起では活性が上昇する。 (B)どちらの樹状突起にもシナプスが豊富にある場合は、どちらもRhoAの活性が低下する。
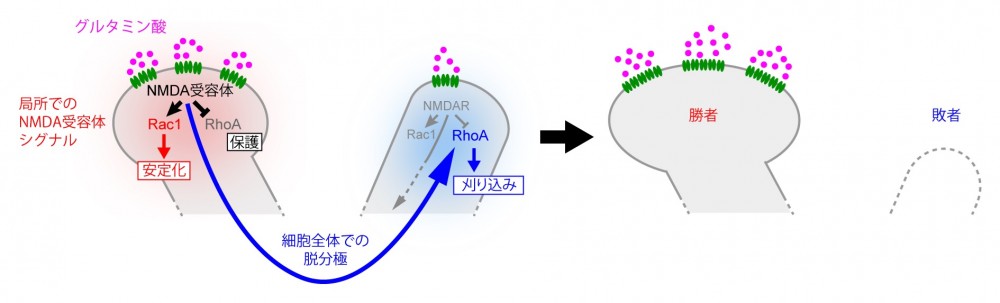 (図8) 僧帽細胞の樹状突起が1本のみを残してそれ以外が刈り込まれる仕組み
(図8) 僧帽細胞の樹状突起が1本のみを残してそれ以外が刈り込まれる仕組み強いグルタミン酸の入力を受けた樹状突起では局所でのNMDA受容体シグナルにより刈り込み分子であるRhoAが抑制され、刈り込みから保護される。続いて起こる細胞全体での脱分極により、RhoAが活性化され、側方抑制シグナルとして樹状突起を刈り込む。最終的に、1本の樹状突起が「勝者」として強化され、それ以外の樹状突起が「敗者」として除去される。
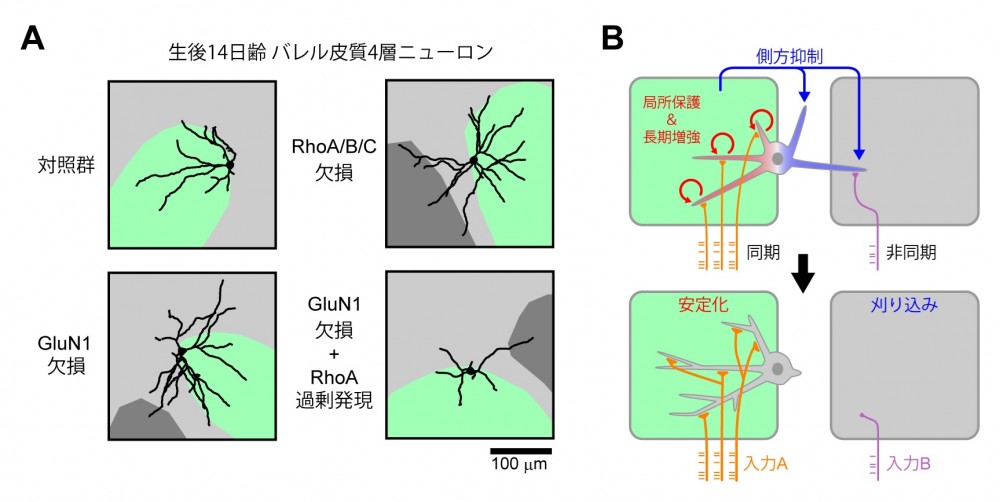 (図9)バレル皮質4層ニューロンにおける側方抑制シグナルを介した受容野形成機構
(図9)バレル皮質4層ニューロンにおける側方抑制シグナルを介した受容野形成機構(A)バレル皮質4層ニューロンは発達期に樹状突起の刈り込みにより1つのバレル(緑色で表示)へ樹状突起を配向させる。GluN1を欠損させると配向性が確立できなくなることが知られているが、RhoA/B/Cを欠損させても配向性が確立できなくなる。GluN1を欠損した4層ニューロンにRhoAを過剰発現すると、刈り込み異常は回復するが配向性の異常は回復しない。 (B)バレル内に伸びた樹状突起は同期的な入力を受けるため、複数の樹状突起があってもそれらすべてが安定化される。一方、バレル外や別のバレルに伸びた樹状突起はバレル内の強い入力からの側方抑制シグナルを受けて刈り込まれる。

