2023.10.14
「ダイレクトリプログラミングによりニューロンを新⽣、脳梗塞後の機能回復に成功」(基盤幹細胞学分野 中島 欽一 教授)
〜新たな神経疾患治療法開発に期待〜
- ① 脳⾎管疾患はしばしば後遺症を起こし、介護が必要になる主たる原因疾患となっています。
- ② 本研究では、ミクログリア/マクロファージからニューロンへのダイレクトリプログラミングにより、脳梗塞モデルマウスでの損傷後の神経機能を回復させることに成功しました。
- ③ 失われたニューロンを補充することができる、全く新しい神経疾患治療法の開発の⼀助となることが期待されます。
概要
脳⾎管疾患は、しばしば重度な後遺症を起こしたり再発したりして予後不良なことがあり、介護が必要になる、主たる原因疾患となっています。脳⾎管疾患の 7 割以上は脳梗塞であり、傷害された脳の修復には、失われた神経細胞(ニューロン)を補充するために新しいニューロンを⽣成することが理想的ですが、成体哺乳類の脳には限られたニューロン新⽣能⼒しか保持されていません。
九州⼤学病院の⼊江剛史医員と同⼤学医学研究院の松⽥泰⽃助教、磯部紀⼦教授、中島欽⼀教授らの研究グループは、脳内のミクログリア(※1)を直接ニューロンに分化転換すること(ダイレクトリプログラミング)が、脳梗塞の治療戦略として⼤きな可能性を持つことを明らかにしました。
本研究グループは、ミクログリア/マクロファージからニューロンへの直接分化転換により、脳梗塞モデルマウスでの損傷後の神経機能を回復させることに成功しました。成体の局所脳虚⾎モデルマウスにおいて、ニューロンの消失が顕著であった梗塞中⼼部にミクログリア/マクロファージが集積しており、このミクログリア/マクロファージに神経誘導性転写因⼦ NeuroD1 を発現させると、既存の神経回路に機能的に組み込まれるニューロン(induced neuronal cell : iN 細胞)への分化転換が可能になりました。さらに、NeuroD1 を介した iN 細胞の⽣成は、局所脳虚⾎モデルマウスの神経機能を著しく改善し、こ の細胞を除去すると、得られた機能回復が無効となりました。このように、ダイレクトリプログラミン グによって新⽣されたニューロンが直接寄与し、脳梗塞後の機能を回復できることが明らかになりまし た。
本研究成果は国際学術誌「Proceedings of the National Academy of Sciences of the United States of America」に 2023 年 10 ⽉ 10 ⽇(現地時間)に掲載されました。
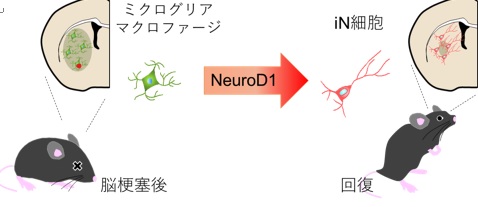
NeuroD1 は、局所脳虚⾎モデルマウスの梗塞巣において、ミクログリア/マクロファージをニューロン(iN細胞)に転換し、脳梗塞後の機能回復に⼤きく寄与する。
脳⾎管疾患は、しばしば重度な後遺症を起こしたり再発したりして予後不良なことがあり、介護が必 要になる原因疾患の第2 位(寝たきりに相当する要介護 5 では第 1 位)となっています(2022 年 国⺠⽣活基礎調査の概況 厚⽣労働省)。
脳⾎管疾患の 7 割以上は脳梗塞であり、障害された脳の修復には、失われたニューロンを補充するために新しいニューロンを⽣成することが理想的ですが、現在、脳梗塞治療に関して細胞移植などにより 失われたニューロンを補充するような根本的治療法は確⽴していません。近年、特定の転写因⼦遺伝⼦ を導⼊することで、本来は神経活動を⾏わない細胞からニューロン(induced neuronal cell : iN 細胞) を産出する直接分化転換法 (ダイレクトリプログラミング)が開発されました。この⽅法を利⽤し、脳や 脊髄の損傷部周辺に存在するアストロサイトをニューロンへと直接分化転換する⽅法が報告されてい ますが、新たに作製・供給されたニューロンの数が少ないなどの問題点から、運動機能の回復に乏しく、 iN 細胞が直接回復に寄与した報告はありません。
それに対し、虚⾎後に死細胞を除去するために神経組織損傷部に集積する、免疫担当細胞ミクログリア/マクロファージを直接ニューロンへと転換することができれば、神経機能回復につながる可能性があると着⽬しました。ミクログリアは、成体脳において⾼い増殖・再⽣能を維持しており、枯渇するこ とがないことが分かっているため、分化転換のための材料細胞としても最適と考えられます。
局所脳虚⾎処置の MCAO モデル(※2)の成体マウスにおいて、脳虚⾎後 7 ⽇の線条体(※3)内に、ニューロンの消失が顕著であった梗塞中⼼部にミクログリア/マクロファージの集積を認めました(図 1)。そこで、ニューロン誘導性転写因⼦ NeuroD1 を発現させるレンチウイルス(※4)を梗塞巣に投与すると、ミクログリア/マクロファージから iN 細胞への分化転換が誘導され(図 2)、既存の神経回路に機能的に組み込まれることがわかりました。また、このような新⽣ニューロンが補充されることで脳虚⾎後 8 週でのニューロン損失領域が⾮治療群と⽐較して減少していました(図 3)。さらに、NeuroD1 を介した iN 細胞の⽣成は、局所脳虚⾎モデルマウスの神経機能を著しく改善し、iDTR マウスを(※5) ⽤いてこの iN 細胞を除去すると、得られた機能回復が無効となりました(図 4)。このように、ダイレクトリプログラミングによって新⽣されたニューロンが直接寄与し、脳梗塞後の機能を回復できることが明らかになりました。
成体マウスにおいて、ダイレクトリプログラミング(直接分化転換)法により、失われたニューロンを速やかに補充することができる、全く新しい神経疾患治療法が⽰されました。しかし、ヒトミクログリアを NeuroD1 でニューロンへと直接分化転換できるかどうかは不明です。これまでヒト線維芽細胞 からニューロンへの分化転換では、マウスの場合と同じ転写因⼦の発現でも効率は悪いものの誘導でき ること、さらに1つの転写因⼦の発現を追加すればその効率を上げられることが報告されていることか ら、NeuroD1 単独あるいは他の因⼦との組み合わせで効率の良い分化転換が可能になるのではないか と考えています。
本研究では、ゲノムに外来遺伝⼦が挿⼊されるレンチウイルスを使⽤しています。これに関しては、マウス、⾮⼈類霊⻑類での実験で安全性の確認を⾏い、問題があった場合、ゲノム⾮挿⼊性のウイルス (例えばセンダイウイルスや AAV など)への変更も検討する必要があります。また、本研究は脳虚⾎後 7 ⽇に治療介⼊を⾏いましたが、それ以降の慢性期でも治療効果が得られる かみていきたいと考えています。
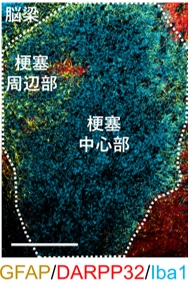
MCAO 後 7 ⽇ の 線条体内に、DARPP32 陽性ニューロンが⽋損している梗塞中⼼部に、Iba1 陽性ミクログリア/マクロファージが集積している。GFAP 陽性アストロサイトがその周辺部に存在している。
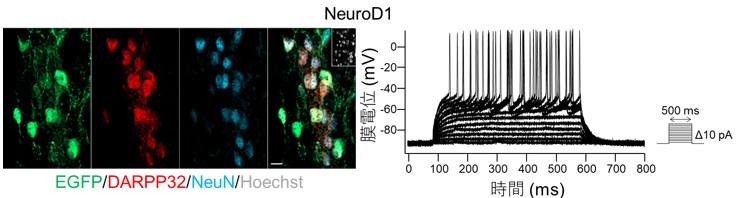
MCAO 後 7 ⽇にミクログリア/マクロファージに NeuroD1 を強制発現させる(図左、EGFP 陽性細胞)と、線条体投射ニューロンのマーカーである DARPP32 を発現する、線条体ニューロン様細 胞へと分化転換していく。パッチクランプ法を⽤いた線条体 iN 細胞の細胞膜電流測定 (図右) を実施すると、iN 細胞は神経活動を⾏っていることがわかった。
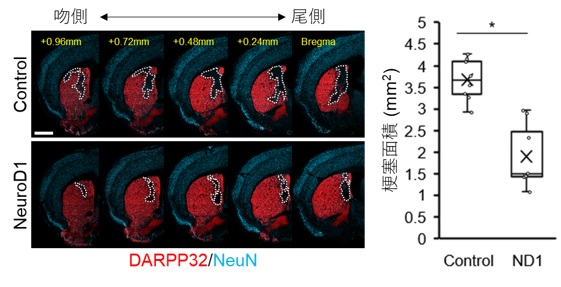
NeuroD1 をミクログリア/マクロファージに発現させると (左図下)、DARPP32 陽性の線条体 iN 細胞が増加するため、梗塞領域が減少する (左図⽩点線、右グラフ)。
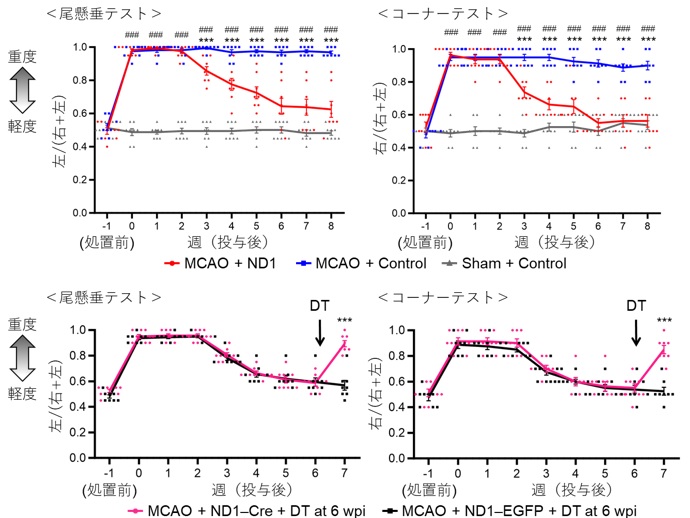
MCAO 前と後 1 週間毎に尾懸垂テスト、コーナーテストで機能評価を⾏った。処置前の全群、MCAO のない Sham 群が⽰すように、障害がなければ左右差のない 0.5 前後の値を⽰し、障害が強くなるほど 1 に近づく。MCAO+ND1 群は MCAO+コントロール群と⽐べて、MCAO 後に増悪した尾懸垂テスト、コーナーテストの改善を認めた(上図)。iDTRマウスで MCAO を起こし、iN 細胞にジフテリア毒素受容体を発現させ、脳梗塞機能改善後にジフテリア毒素(DT)を投与して iN 細胞を除去したところ、改善していた尾懸垂テスト、コーナーテストが再び悪化した(下図)。
(※1) ミクログリア
グリア細胞の 1 種で脳内では唯⼀の免疫担当細胞。脳内・脳外の環境変化に⾮常に敏感で、それらを感知すると即座に⼤きく変化して、病気の発症や進⾏を先導する役割を果たしている。ミクログリアは、成体脳において⾼い増殖・再⽣能を維持しており、枯渇することがないことが分かっている。ただし、発現している遺伝⼦は別の免疫細胞マクロファージと⾮常に似ているため区別が難しく、ここではミクログリア/マクロファージと記載している。
(※2) MCAO モデル
局所脳虚⾎モデル。⾎管内閉塞法で右中⼤脳動脈起始部を 30 分間閉塞させる局所脳虚⾎処置により作製した。
(※3) 線条体
脳領域の 1 つ。成体脳において、この領域では、通常新しいニューロンはほとんど産⽣されない。
(※4) レンチウイルス⾃⼰複製(ウイルス粒⼦)能⼒を⽋いた遺伝⼦組み換えレンチウイルス粒⼦。⾮分裂細胞を含むほぼ全ての哺乳動物細胞やモデル動物全体に遺伝⼦を導⼊し定常発現させる上で最も効果的な媒体の1つ。
(※5) iDTR マウス
Cre 誘導下で細胞特異的にジフテリア毒素受容体(DTR)を発現させるトランスジェニックマウス。ジフテリア毒素を投与することによって DTR 発現細胞を特異的に破壊することができる。
本研究は JSPS 科研費 (JP18K14820、JP16H06527、JP16K21734、JP19K22473、JP23K18451、 JP21H02808)、AMED(JP21bm0404057, JP20gm1310008)、九州⼤学 QR プログラム わかばチャレ ンジ、⾙原守⼀医学振興財団、武⽥科学振興財団、野⼝研究所、鈴⽊謙三記念医科学応⽤研究財団、内 藤記念科学振興財団の助成を受けたものです。
掲載誌:Proceedings of the National Academy of Sciences of the United States of America
タイトル:Direct neuronal conversion of microglia/macrophages reinstates neurological function after stroke
著者名:Takashi Irie, Taito Matsuda*, Yoshinori Hayashi, Kanae Matsuda-Ito, Akihide Kamiya, Takahiro Masuda, Marco Prinz, Noriko Isobe, Jun-ichi Kira, Kinichi Nakashima*.
*=共同責任著者
DOI :10.1073/pnas.2307972120
TEL:092-642-6195 FAX:092-642-6561
Mail:nakashima.kinichi.718★m.kyushu-u.ac.jp
※★→@に置き換えてメールをご送信ください

