2018.03.12
「脊髄損傷に対する神経幹細胞移植の治療効果を増強させる治療法の発見」基盤幹細胞学分野 中島欽一教 教授
脊髄損傷に対する神経幹細胞移植の治療効果を増強させる治療法の発見!
〜脊髄損傷の新たな治療法開発に期待〜
〜脊髄損傷の新たな治療法開発に期待〜
九州大学大学院医学研究院の中島欽一教授と、鹿児島大学大学院医学系学府博士課程4年の上薗直弘らの研究グループは、岡山大学大学院医歯薬学総合研究科の西堀正洋教授らとの共同研究により、マウスにおいて脊髄損傷の急性期に抗HMGB1(※1)抗体を投与すると、血液—脊髄関門の透過性亢進を抑制し、それに引き続く脊髄浮腫を軽減させることを発見しました。それにより損傷領域の拡大が抑えられ、また損傷領域周辺の介在ニューロン(神経細胞)死も軽減することから、その後の神経回路再構築に有利に働き、後肢運動機能を回復させることに成功しました。
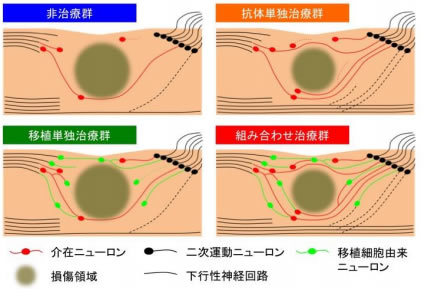
さらに、急性期の抗体治療に引き続き、ヒトiPS細胞(※2)由来神経幹細胞(※3)を損傷脊髄に移植したところ、それぞれの単独治療で得られる治療効果と比べ、劇的に高い治療効果を得られることが明らかになりました。移植細胞から分化したニューロン(※4)が、再構築された神経回路の一部を担い運動機能回復に直接寄与することはこれまで報告されていましたが、抗体治療により損傷周辺部の環境を整備することで、移植細胞由来ニューロンが機能回復につながるシナプスを形成する機会を増やしたことがこのような高い治療効果につながったと考えられます(図 1)。この成果により、脊髄損傷の新たな治療戦略につながることが期待されます。
本研究成果は、2018年3月8日(木)午前11時(米国東部時間)に、国際学術雑誌『Stem Cells』
のオンライン版に掲載されました。
さらに、急性期の抗体治療に引き続き、ヒトiPS細胞(※2)由来神経幹細胞(※3)を損傷脊髄に移植したところ、それぞれの単独治療で得られる治療効果と比べ、劇的に高い治療効果を得られることが明らかになりました。移植細胞から分化したニューロン(※4)が、再構築された神経回路の一部を担い運動機能回復に直接寄与することはこれまで報告されていましたが、抗体治療により損傷周辺部の環境を整備することで、移植細胞由来ニューロンが機能回復につながるシナプスを形成する機会を増やしたことがこのような高い治療効果につながったと考えられます(図 1)。この成果により、脊髄損傷の新たな治療戦略につながることが期待されます。
本研究成果は、2018年3月8日(木)午前11時(米国東部時間)に、国際学術雑誌『Stem Cells』
のオンライン版に掲載されました。
|
研究者からひとこと:
偶然学会でお聞きした西堀先生の抗体研究と、私たちが行ってきた幹細胞移植を組み合わせることで、それぞれ単独よりも劇的な効果が見られました。それを実現させた上薗君の頑張りにも敬意を表したいと思います。 |
 |
|
 |
↑図1 抗HMGB1抗体治療と神経幹細胞移植治療の組み合わせによる治療増強効果の概念図 ←写真 上薗君は最後列、左から二番目、中島教授は最後列、右端 |
|
| 【お問い合わせ】 | 九州大学大学院医学研究院 教授 中島 欽一(なかしま きんいち) |
| 電話:092-642-6195 FAX:092-642-6561 Mail:kin1(a)scb.med.kyushu-u.ac.jp ※(a)は@に置きかえてメールをご送信ください |
脊髄が損傷されると、損傷レベル以下の感覚と運動機能が失われる。我が国では年間約5千人の新規脊髄損傷患者が発生しており、その総数は10万人以上と言われる。現在、臨床の現場で脊髄損傷に対して行われる治療は、全身管理や脱臼、骨折部を再建する手術およびリハビリテーションであり、中枢神経そのものを回復させる治療法はない。この問題を解決するために多くの脊髄損傷モデル動物を用いた再生治療研究がなされており、損傷部の炎症を抑制しさらなる神経回路の破綻を防止する方法や、損傷した軸索の再伸長を促進し神経回路を再構築させる方法など様々な方法が試されているが、これまでに確固たる治療法の開発には至っていない。 近年、ニューロン、アストロサイトおよびオリゴデンドロサイトへの分化能を有する神経幹細胞の移植による脊髄損傷治療に注目が集まっている。しかしこれらは、他の研究報告と合わせて完全回復にはほど遠く、依然方法改善の余地が残されている。移植された神経幹細胞がより機能的に働くような環境を整備するにはどうすればよいのであろうか。これまでの神経幹細胞移植は、直接的な損傷( 一次損傷) だけでなく、血液-脊髄関門の破綻による浮腫や続発する炎症反応によって激しく破壊( 二次損傷) を受けた脊髄へなされている。
そこで研究グループは、この二次損傷を何らかの方法で抑制し、損傷部ダメージを軽減した上で神経幹細胞を移植すれば、さらに高い効果が得られるのではないかと考えるに至った。今回、損傷部環境を改善・整備する方法として、抗HMGB1抗体の投与を選択した。HMGB1は非ヒストン性のDNA結合タンパクとして核に存在するが、 脳虚血・挫傷により細胞外へ放出される。放出されたHMGB1は、血管内皮細胞や血管周皮細胞に作用して血液-脊髄関門の破綻が生じ、 浮腫やさらなる炎症反応を誘導し、損傷部の破壊を進行させると考えられている。このような状況の中、共同研究者の西堀らは、HMGB1の作用を抗HMGB1抗体により阻害したところ、脳虚血・挫傷後の二次損傷が劇的に抑制出来ることを突き止めた(Liu K et al., FASEB J 2007, Okuma Y et al., Ann Neurol 2012)。同じ中枢神経系である脊髄における損傷でもHMGB1は同様に作用している可能性は高いと考えられ、本研究ではまず抗HMGB1抗体を脊髄損傷モデルマウスに投与することで後肢運動機能を改善できるかどうかを検証した。さらにヒトiPS細胞由来神経幹細胞の移植を併用させることにより、移植細胞の挙動を観察し、抗体もしくは移植単独治療よりさらに後肢運動機能改善が見られるかどうかを検討した。
■内 容
マウスの第10胸髄レベルにコンピューター制御下に一定の力を加えて圧挫損傷モデルを作製した。損傷5分および6時間後に抗HMGB1抗体もしくは対照抗体を腹腔内注射にて2回投与した。さらに損傷1週目に50万個のヒトiPS細胞由来神経幹細胞もしくは細胞培養液のみを損傷中心部に注入し、それぞれの組み合わせである4群を作製した。Basso Mouse Scale (BMS)スコアと呼ばれるマウス後肢の動きの程度を指標にしたスコアリング法を用いて、脊髄損傷による麻痺からの回復度合いを評価した。図2に示す通り、抗体単独治療では神経幹細胞移植単独治療と同等の後肢運動機能改善効果を認めた。脊髄損傷の急性期に抗体を投与することにより、血液—脊髄関門の透過性亢進を抑制し、それに引き続く脊髄浮腫を軽減させることも分かった。それにより損傷領域の拡大が抑えられ、損傷領域周辺の介在ニューロンの生存率も向上した。また、損傷部より遠位におけるセロトニン作動性ニューロン(※5)の神経線維の数が有意に増大しており、これらにより神経回路の再構築が行われ、後肢運動機能を回復させたと考えられた。
さらに組み合わせ治療ではそれぞれの単独治療群の効果を劇的に促進した。この研究の計画立案時には抗体治療により環境を整備することで、移植細胞の生存率を向上させるのではないかと予想していたが、生存率および分布のどちらも移植単独治療と大きな差を認めなかった。また、我々の使用したヒトiPS細胞由来神経幹細胞は70%以上の割合で高効率にニューロンへと分化することがわかっていたが(Fujimoto Y. et al, Stem Cells 2012)、抗体治療による分化への影響は観察されなかった。したがって、移植iPS細胞由来神経幹細胞から分化したニューロンが、抗体治療により生存した損傷領域周辺部の宿主ニューロンと効率よくシナプスを形成できることが、この組み合わせ治療の劇的な機能回復につながったのではないかと考えた。これらの移植細胞由来ニューロンのみ、あるいは宿主ニューロンと同時に除去すると回復した運動機能が悪化する傾向がみられたことから、これらのニューロンは運動機能回復に直接に関与していることが明らかとなった。
■効果・今後の展開
本成果は、我が国が世界に先駆けて脊髄損傷における iPS 細胞由来神経幹細胞移植を臨床応用しようとする準備段階にある現在において、さらにその可能性を拡げるものになると考える。また、臨床応用を考慮した場合、損傷直後に本抗体を投与することは現実的ではなく、損傷後どのくらいの時間を空けて投与した場合にも有効であるのか、ヒト化した抗体でも効果があるのかなどの検討が必要。

【用語解説】

| (※1) | HMGB1 |
| High-mobilitygroupbox1は全ての有核細胞の核内に存在する非ヒストン核 蛋白質であり、遺伝子発現の調節に関わっている。しかし、損傷時には細胞外へ 放出されたHMGB1は炎症性サイトカインの様に働くことが知られている。 |
| (※2) | iPS細胞 |
| 京都大学の山中伸弥教授らが開発した方法によって体細胞をリプログラムして作製した、様々な組織や臓器の細胞に分化する能力をもった多能性幹細胞。 |
| (※3) | 神経幹細胞 |
| 中枢神経を構成するニューロンやその機能を支持するアストロサイト及びオリゴデンドロサイトへと分化できる多分化能をもった細胞。 |
| (※4) | ニューロン(神経細胞) |
| 脳・脊髄・神経を構成している細胞の一種で、その機能は情報処理と情報伝達に特化しており、体全体の筋肉や臓器を機能させたり、様々な感覚を脳へ伝えたりする役割を果たしている。 |
| (※5) | セロトニン作動性ニューロン |
| セロトニンは神経伝達物質としての機能があり、脳幹の縫線核群で合成される。このセロトニン作動性ニューロンが、脊髄損傷後の運動機能回復において重要な役割を担っていることが報告されている。 |

