2019.01.07
「免疫の司令塔、樹状細胞の代謝・活性化における重要な経路を発見 」(臨床検査医学分野 康東天教授・後藤和人助教)
免疫の司令塔、樹状細胞の代謝・活性化における重要な経路を発見
― 卵アレルギーや自己免疫疾患の創薬開発への新たな方向性 ―
九州大学医学研究院臨床検査医学分野の康東天教授、後藤和人助教らの研究グループは、九州大学生体防御医学研究所の福井宣規主幹教授らの研究グループと共同で、免疫細胞の司令塔である樹状細胞の代謝・活性化を制御する分子の一つとして p32 という遺伝子を同定しました。さらに、卵アレルギーの病態モデルマウスを用いて、p32 遺伝子の欠損やピルビン酸デハイドロゲナーゼという酵素の阻害剤であるCPI-613という化合物が卵アレルギーの病態を軽減する可能性があることを示唆しました。
樹状細胞はラルフ・スタインマン博士(2011年ノーベル生理学・医学賞受賞)により発見され、免疫細胞の司令塔として機能することが明らかにされつつあります。この樹状細胞は、病原体に対する免疫応答のみならず、過剰な免疫応答を抑制する免疫寛容にも関与しているため、アレルギー性疾患や自己免疫疾患への関連が指摘されています。特に食物アレルギーは、厚生労働省の推定によれば、全人口の1~2%(乳児に限定すると約10%)に何らかの食物アレルギーを持っているものと推定されていますが、これまでに有用な治療法が見いだせていないのが現状です。
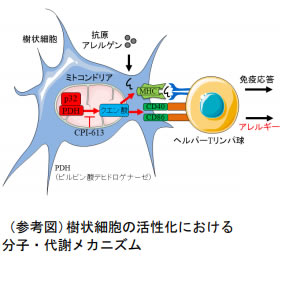
研究グループは、ミトコンドリアに局在したんぱく質の翻訳や代謝を制御する分子の一つであるp32に着目し、樹状細胞の代謝・活性化におけるミトコンドリアを介する経路の一つを明らかにしました。その代謝経路の中で特にピルビン酸デヒドロゲナーゼという酵素がミトコンドリア内でのクエン酸合成や樹状細胞の活性化に重要な因子であることがわかりました。ピルビン酸デヒドロゲナーゼの阻害剤であるCPI-613という低分子化合物は、樹状細胞の活性化を阻害しました。さらに、この阻害剤はマウスの卵白アルブミンを用いた卵アレルギーの病態モデルにおいて、p32 部分欠損マウスと同様に卵白アルブミンに対する抗体産生量を減少させました。これらの結果により、p32やピルビン酸デヒドロゲナーゼの阻害は、卵アレルギーを含むアレルギー性疾患の創薬開発につながることが期待されます。
本研究は、日本学術振興会(JSPS)科学研究費補助金(16K19196、18K11077、26860512、25893162、18H07417、15H04764、24590387、17H01550、25253041)・武田科学振興財団などの支援を受けており、2018年11月13日(米国東部時間)に科学誌「Cell Reports」のオンライン版で公開されました。
樹状細胞はラルフ・スタインマン博士(2011年ノーベル生理学・医学賞受賞)により発見され、免疫細胞の司令塔として機能することが明らかにされつつあります。この樹状細胞は、病原体に対する免疫応答のみならず、過剰な免疫応答を抑制する免疫寛容にも関与しているため、アレルギー性疾患や自己免疫疾患への関連が指摘されています。特に食物アレルギーは、厚生労働省の推定によれば、全人口の1~2%(乳児に限定すると約10%)に何らかの食物アレルギーを持っているものと推定されていますが、これまでに有用な治療法が見いだせていないのが現状です。
研究グループは、ミトコンドリアに局在したんぱく質の翻訳や代謝を制御する分子の一つであるp32に着目し、樹状細胞の代謝・活性化におけるミトコンドリアを介する経路の一つを明らかにしました。その代謝経路の中で特にピルビン酸デヒドロゲナーゼという酵素がミトコンドリア内でのクエン酸合成や樹状細胞の活性化に重要な因子であることがわかりました。ピルビン酸デヒドロゲナーゼの阻害剤であるCPI-613という低分子化合物は、樹状細胞の活性化を阻害しました。さらに、この阻害剤はマウスの卵白アルブミンを用いた卵アレルギーの病態モデルにおいて、p32 部分欠損マウスと同様に卵白アルブミンに対する抗体産生量を減少させました。これらの結果により、p32やピルビン酸デヒドロゲナーゼの阻害は、卵アレルギーを含むアレルギー性疾患の創薬開発につながることが期待されます。
本研究は、日本学術振興会(JSPS)科学研究費補助金(16K19196、18K11077、26860512、25893162、18H07417、15H04764、24590387、17H01550、25253041)・武田科学振興財団などの支援を受けており、2018年11月13日(米国東部時間)に科学誌「Cell Reports」のオンライン版で公開されました。
 |
 |
|
研究者からひとこと:
本研究成果により、p32・ピルビン酸デハイドロゲナーゼ・クエン酸が樹状細胞の活性化における重要な分子・代謝産物であることを見いだすことができました。さらに、低分子化合物のCPI-613が卵アレルギーなどのアレルギー性疾患の新たな創薬につながることを見いだすことができました。 |
※(a)を@に置きかえてメールを送信してください。
| 【お問い合わせ】 | 大学院医学研究院 教授 康 東天、九州大学病院 助教 後藤和人 |
| 電話:092-642-5752 FAX:092-642-5772 Mail:kang(a)cclm.med.kyushu-u.ac.jp、gotou.kazuhito.712(a)m.kyushu-u.ac.jp ※(a)を@に置きかえてメールをご送信ください。 |
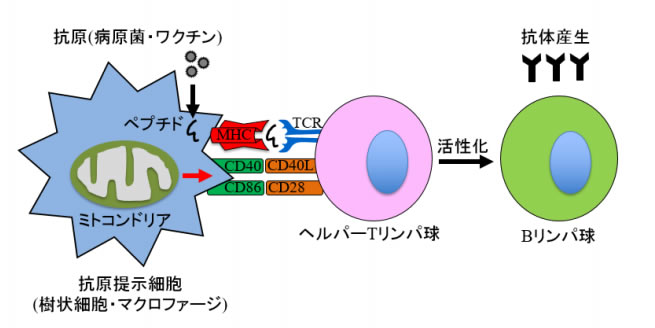
樹状細胞※1は1973年にラルフ・スタインマン博士(2011年ノーベル生理学・医学賞受賞)らにより発見され、免疫細胞の司令塔として機能することが明らかにされつつあります。この樹状細胞は、病原体に感染した際には、ウイルスや細菌など病原菌を「非自己」と認識して、リンパ球を活性化させることにより病原菌に対抗する司令塔として働くことが知られています。逆に自己のたんぱく質や食物などの生体に必要な物質に対して過剰に免疫応答を起こさないような「免疫寛容」にも関与しています。自己のタンパク質などに対して過剰な免疫反応を起こしてしまう疾患を「自己免疫疾患」、食品などの異物に対して過剰に免疫応答を起こしてしまう疾患を「アレルギー性疾患」と呼びますが、樹状細胞はその増悪にも関与していると考えられています。
特に食物アレルギーは、厚生労働省の推定によれば、全人口の1~2%(乳児に限定すると約10%)に何らかの食物アレルギーを持っているものと推定されていますが、これまでに有用な治療法が見いだせていないのが現状です。
■ 内容
研究グループは、世界に先駆けてp32※2という分子がミトコンドリアというオルガネラに局在して(1997年)、細菌感染の増悪に重要な役割を果たしていること(2017年)を明らかにしました。このp32という分子は、ミトコンドリア内で、たんぱく質を作ることやエネルギー代謝をすることに関与していると推定されています。近年、樹状細胞のミトコンドリアの代謝が病原菌への免疫応答や卵アレルギーの病態モデルマウス※3の増悪に関与していることが示唆されました。そこで、研究グループは、独自のp32部分欠損マウスを樹立して、樹状細胞の新たな代謝・活性化経路の探索を試みました。
まず、卵アレルギーの原因成分の一つであるオボアルブミンをマウスに投与して、それに対して反応する抗体量とリンパ球の数を解析しました。その結果、野生型マウスと比較して、p32部分欠損マウスにおいてはオボアルブミンに対して反応する抗体の量が有意に減少していました(図1左)。次にこの抗体量の低下が樹状細胞のp32遺伝子の欠損による影響だと考えて、野生型マウスとp32部分欠損マウスからそれぞれ採取した樹状細胞にオボアルブミンを加えて培養した後に野生型マウスに移入しました。予想通り、p32欠損樹状細胞を移入した群において、オボアルブミンに反応するCD8陽性Tリンパ球の数が減少していました(図1左)。これらの結果により、我々は樹状細胞におけるp32遺伝子が卵アレルギーの増悪に関与していると考えました。
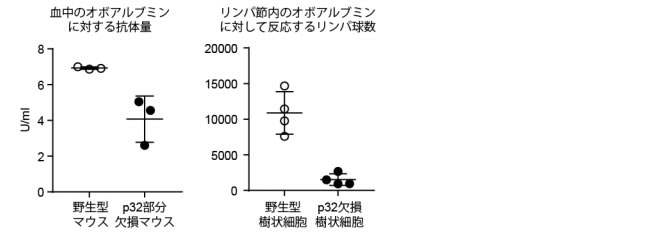 |
| 図 1:マウスの腹腔にオボアルブミンと免疫賦活剤を投与した後の血中のオボアルブミンに対する抗体量(左)とリンパ節内のオボアルブミンに対して反応するCD8陽性Tリンパ球の数(右) |
次に我々は、p32欠損樹状細胞の特徴を解析しました。これまでの我々の報告と一致して、p32のたんぱく質はミトコンドリアに局在していました(図 2A)。さらに、p32の遺伝子を欠損させた樹状細胞は、電子顕微鏡においてミトコンドリアの構造そのものが崩壊しており(図 2B)、代謝の変化により細胞培養液の上清が酸性に変化することがわかりました(図 2C)。さらに、糖分を利用して作られる乳酸がp32欠損樹状細胞において増加し、逆にミトコンドリアの代謝が低下していることより、p32遺伝子はミトコンドリア依存的な代謝も制御することが明らかになりました。
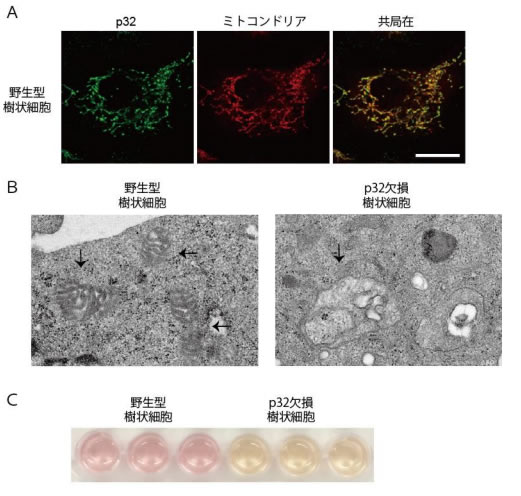 |
| 図 2:A 共焦点顕微鏡でのp32とミトコンドリアの共局在、B 電子顕微鏡でのミトコンドリア像矢印がミトコンド リア、C 樹状細胞の培養上清フェノールレッドの色調の変化(黄色が酸性) 病原菌の感染時などには、樹状細胞はリンパ球に抗原提示※4 するために細胞膜の表面にMHCやCD40/86と言う抗原提示分子を発現します。そこで、大腸菌の細胞壁成分の一つであるリポポリサッカライド(LPS)とウイルスなど病原体に特有の配列を持った非メチル化DNA(CpG)で野生型樹状細胞とp32欠損樹状細胞を刺激しました。その結果、野生型樹状細胞と比較してp32欠損樹状細胞において、MHCやCD40/86の細胞膜表面への発現が低下していました(図 3)。 |
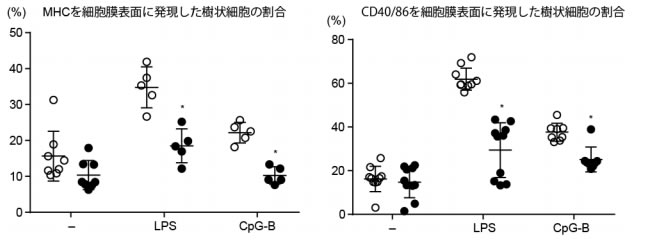 |
| 図 3:LPS(大腸菌の細胞壁成分)、CpG(非メチル化DNA)を投与した後のMHC(左)、CD40/86(右)の細胞膜表面への発現の割合 さらにその代謝メカニズムを解析するためにLPSを投与した後の樹状細胞の代謝産物を測定しました。160種類程度の代謝産物を測定したところ、p32欠損樹状細胞においてクエン酸の量が低下していることがわかりました(図 4A)。ミトコンドリア内でクエン酸へ変換するための重要な酵素の一つはピルビン酸デハイドロゲナーゼですが、p32 欠損樹状細胞においてこの酵素の活性が低下していました(図 4B)。さらに、我々は直接p32とピルビン酸デハイドロゲナーゼが結合することにより相互作用し、ピルビン酸デハイドロゲナーゼの阻害が樹状細胞の抗原提示能を低下させることを見いだしました。これらの結果により、樹状細胞の活性化において、ピルビン酸デハイドロゲナーゼの活性化が必要であることがわかりました。 |
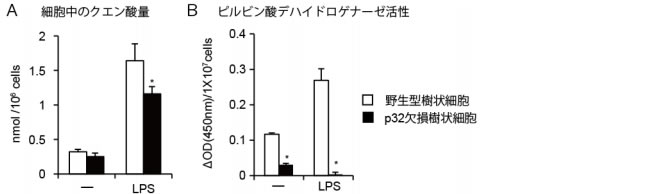 |
| 図 4:A LPSで刺激前(左)、刺激後(右)の細胞内のクエン酸の量B LPSで刺激前(左)、刺激後(右)の細胞内のピルビン酸デハイドロゲナーゼ活性 最後に、この代謝経路が卵アレルギーの増悪に関与しているのか解析しました。ピルビン酸デハイドロゲナーゼの既知の阻害剤であるCPI-613という低分子化合物を野生型マウスの腹腔に投与しますと、p32部分欠損マウスと同様に、オボアルブミンに対して反応する抗体の量がともに有意に減少していました(図 5 左)。この低下が樹状細胞に依存しているかを調べるために、野生型樹状細胞にCPI-613とオボアルブミンを加えて培養した後に野生型マウスに移入しました。CPI-613を加えた群において、オボアルブミンに反応するCD8陽性Tリンパ球の数が減少していました(図5左)。これらの結果より、樹状細胞の代謝・活性化にp32遺伝子は重要な役割を演じており、卵アレルギーの増悪にp32遺伝子やピルビン酸デハイドロゲナーゼの活性化が関与していることが指摘されました。ピルビン酸デハイドロゲナーゼの阻害剤である CPI-613は、卵アレルギーなどのアレルギー性疾患の新規薬剤の候補の一つとなりうると考えられます。 |
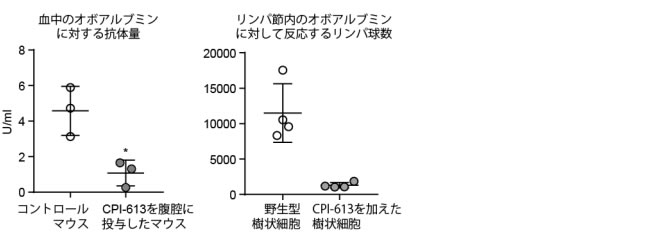 |
| 図 5:マウスの腹腔にCPI-613を投与した後に、オボアルブミンと免疫賦活剤を投与した後の血中のオボアルブミンに対する抗体量(左)とCPI-613とオボアルブミンを加えて培養した樹状細胞を野生型マウスに投与した後のリンパ節内のオボアルブミンに対して反応するCD8陽性Tリンパ球の数(右) |
■ 今後の展開
本研究により、p32遺伝子が樹状細胞の代謝や活性化を制御するのみならず、一部の「アレルギー性疾患」の増悪にも関与していることが示唆されました。我々は、すでに「自己免疫疾患」の一つである乾癬のモデルマウスにおいてもp32 が重要な役割を演じていることを見出しています。すなわち、さらなるp32遺伝子の解析は、「アレルギー性疾患」・「自己免疫疾患」の新たな疾患メカニズムの解明と創薬開発につながると考えています。
■本研究について
本研究は、文部科学省・日本学術振興会科学研究費補助金(16K19196、18K11077、26860512、25893162、
18H07417、15H04764、24590387、17H01550、25253041)・武田科学振興財団などの成果で、2018年11月13 日(米国東部時間)に科学誌「Cell Reports」のオンライン版で公開されました。
■用語解説
(※1)樹状細胞 ラルフ・スタインマン博士により発見された無数の突起がある免疫細胞。主な機能は、病原菌由来の抗原を取り込み活性化し、抗原提示細胞としてリンパ球などを活性化し免疫応答を引き起こす司令塔細胞である。免疫の活性化・抑制を制御して、アレルギー性疾患や自己免疫疾患の原因細胞の一つと考えられている。近年、がん免疫療法として、保険外診療でも用いられている。
(※2)p32 ミトコンドリアに局在して、ミトコンドリア内のmRNAからたんぱく質への翻訳を促進する分子の一つ。p32 遺伝子が欠損したマウスは胎生致死であり、ヒトにおいてもp32の遺伝子異常は出生後の早期死亡や心不全の原因の一つであると報告されている。
(※3)卵アレルギーの病態モデルマウス ヒトにおいて乳幼児期の食物アレルギーの多くは、鶏卵ないしは牛乳である。鶏卵のアレルギーの約60-90%程度の原因物質がオボアルブミンである。免疫学のマウスの研究にこのオボアルブミンと免疫賦活効果のあるフロイドアジュバントを皮下に投与して、数週間後に血中のオボアルブミンの抗体価を測定することにより、卵アレルギーの病態モデルを作成する。樹状細胞・リンパ球などの機能により抗体価が変化するため、それぞれの細胞レベルの解析も必要である。
(※4)抗原提示 樹状細胞やマクロファージなど抗原提示細胞は病原菌や異物を認識し、抗原の一部を MHCという分子の表面に露出する。提示されている抗原に対応する細胞受容体を持ったリンパ球が抗原提示細胞と架橋することにより活性化し、免疫応答する。この架橋を形成する際に、抗原提示細胞側の架橋を補助する分子を補助刺激分子と呼び、樹状細胞であれば CD40/86 といった分子がそれに該当する。
(※2)p32 ミトコンドリアに局在して、ミトコンドリア内のmRNAからたんぱく質への翻訳を促進する分子の一つ。p32 遺伝子が欠損したマウスは胎生致死であり、ヒトにおいてもp32の遺伝子異常は出生後の早期死亡や心不全の原因の一つであると報告されている。
(※3)卵アレルギーの病態モデルマウス ヒトにおいて乳幼児期の食物アレルギーの多くは、鶏卵ないしは牛乳である。鶏卵のアレルギーの約60-90%程度の原因物質がオボアルブミンである。免疫学のマウスの研究にこのオボアルブミンと免疫賦活効果のあるフロイドアジュバントを皮下に投与して、数週間後に血中のオボアルブミンの抗体価を測定することにより、卵アレルギーの病態モデルを作成する。樹状細胞・リンパ球などの機能により抗体価が変化するため、それぞれの細胞レベルの解析も必要である。
(※4)抗原提示 樹状細胞やマクロファージなど抗原提示細胞は病原菌や異物を認識し、抗原の一部を MHCという分子の表面に露出する。提示されている抗原に対応する細胞受容体を持ったリンパ球が抗原提示細胞と架橋することにより活性化し、免疫応答する。この架橋を形成する際に、抗原提示細胞側の架橋を補助する分子を補助刺激分子と呼び、樹状細胞であれば CD40/86 といった分子がそれに該当する。


