2019.01.10
「脳内に存在する免疫細胞から機能的な神経細胞の作製に成功 」(基盤幹細胞学分野 中島欽一教授・松田泰斗助教)
脳内に存在する免疫細胞から機能的な神経細胞の作製に成功
〜脳梗塞や脊髄損傷など神経疾患治療への応用が期待される画期的な成果〜
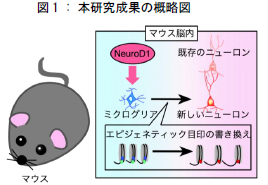
脊髄損傷や脳梗塞などによって神経回路が傷つき失われると、神経伝達機能が絶たれ、運動機能などが障害されます。運動機能回復のためには、新しいニューロンを損傷部位に供給することで、失われた神経回路を再構築する必要があります。ミクログリアは、神経損傷部位に集積して死細胞を除去する性質がある脳・脊髄内の免疫担当細胞ですが、通常はニューロンへ変化することはありません。研究グループは、脳の発生過程でニューロン産生に関わる重要な遺伝子である NeurD1 をミクログリアへ導入すると、ミクログリアの運命制御に関わるエピジェネテ ィクスの書き換えが起こり、結果としてニューロンへのダイレクトリプログラミングが誘導されることを明らかにしました。人為的操作により作製されたニューロンは、既存のニューロンと類似した遺伝子発現パターンを示すだけでなく、シナプスを形成することで神経回路に組み込まれ、自発的な神経活動を行います。このように、作製したニューロンは生体のニューロンと同様の性質を有していることがわかりました。この成果は、損傷部位に集積したミクログリアからニューロンへダイレクトリプログラミングすることで実際に運動機能回復が見られる可能性を示しており、将来的な神経疾患治療への応用が期待できます。
本研究成果は、2019 年 1 月 9 日(水)午前 11 時(米国東部標準時間)に国際学術雑誌『Neuron』に掲載されました。なお、本研究は文部科学省科研費(18K14820、16H06527)、創薬等先端技術支援基盤プラットフォーム(BINDS)(JP16am0101102、JP16am0101103and521、JP16am0101105)の支援を受けました。
 |
 |
 |
研究者からひとこと:
共同研究者を含めてこれまでみんなで頑張ってきた成果を公表できて大変嬉しく思います。今後は脳梗塞や脊髄損傷モデルマウスを使って、本研究で得られた成果が、実際に運動機能の回復に結びつくのかどうかを検討したいと考えています。(松田) |
※(a)を@に置きかえてメールを送信してください。
| 【お問い合わせ】 | 九州大学大学院医学研究院 教授 中島 欽一(なかしま きんいち) |
| 電話:092-642-6195 FAX:092-642-6561 Mail:kin1(a)scb.med.kyushu-u.ac.jp ※(a)を@に置きかえてメールをご送信ください。 |
細胞内のDNAやDNAが巻きつくヒストンにつく目印(DNAメチル化とヒストン修飾)によって、使う遺伝子と使わない遺伝子が決められています。それを総称してエピジェネティクスと言いますが、どの細胞も基本的には同じ遺伝情報を持っているのに、別々の細胞になれるのはこのエピジェネティクスのおかげです。このエピジェネティックな目印づけは、様々な細胞から別々の器官や組織が形作られる発生過程で決定(プログラミング)し、エピジェネティックな目印が一旦つくと容易にははずれないため、一度決定した細胞運命は二度と変更されることはないと考えられていました。しかし、細胞運命の再編成(リプログラミング)に関する近年の目覚ましい研究の進展によって、特定の鍵となる遺伝子を細胞に導入することで、エピジェネティック目印の書き換えが起こり、全く別の細胞へと直接的に変化することがわかってきました。この現象は、細胞運命の直接的なリプログラミングということから「ダイレクトリプログラミング」とも呼ばれ、将来の革新的医療を担う新しい技術として世界中で注目されています。特に、このダイレクトリプログラミングには、生体組織内に存在する自己細胞を直接的に目的細胞へと分化誘導できるという利点があります。そのため、必要とされる細胞種を治療が必要な時期に患者へと供給できる可能性が高くなります。
脊髄損傷や脳梗塞などによって神経回路が傷つき失われると、神経伝達機能が絶たれ、運動機能などが障害されます。運動機能回復のためには、新しいニューロンを損傷部位に供給することで、失われた神経回路を再構築する必要があります。これを解決するために、研究グループは、脊髄損傷や脳梗塞後、損傷部位に存在する、本来はニューロン様活動を行わない細胞をニューロンへとダイレクトリプログラミングすることで、失った神経回路網の修復が見込めるのではないかと考えました。本研究では、神経損傷部位に集積して損傷によって生じた死細胞を除去する役目を持つが、役目を終えた後は不要な免疫細胞ミクログリアに着目し、通常はニューロンへ変化することはないこの細胞に、鍵となる遺伝子を導入することで、ニューロンへとダイレクトリプログラミング可能なのかどうかを検証しました。
■内 容
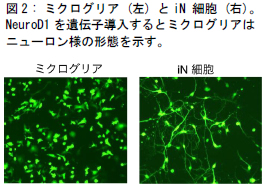
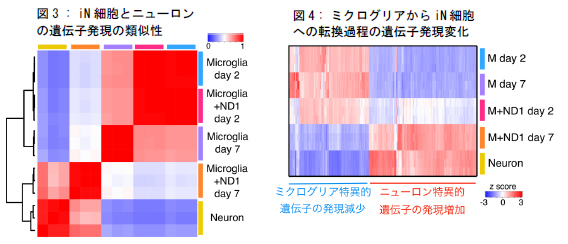
研究グループは、培養皿上のマウス由来ミクログリアに、脳発生過程でニューロン産生に重要と考えられている10個程度の遺伝子を単独あるいは組み合わせて導入しました。すると、たった1つの転写因子NeuroD1をミクログリアに強制発現させるだけで、ニューロン様の細胞(Induced neuronal cell : iN細胞)ができることがわかりました(図 1, 2)。さらに、次世代シーケンサー*1)を用いた網羅的遺伝子発現解析から、作製した iN細胞の遺伝子発現パターンは、実際のニューロンと酷似していることがわかりました(図 3)。また、ダイレクトリプログラミング過程においてニューロンで重要な働きをする遺伝子 (ニューロン特異的遺伝子) の発現上昇と、ミクログリアで重要な働きをする遺伝子(ミクログリア特異的遺伝子) の発現低下が起こっていることも見出しました(図 4)。
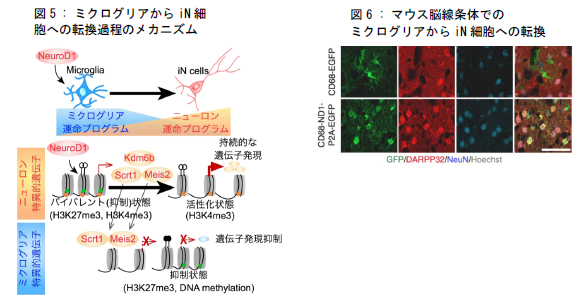
さらに詳細なメカニズムを明らかにするために、次世代シーケンサーを用いてミクログリアのエピジェネティックな目印がどのように変化しているのかを調べました。その結果、ミクログリアにおいてニューロン特異的遺伝子は、遺伝子発現に対して正と負それぞれに働く(相反する)ヒストン修飾を同時にもっている、バイバレント状態*2)によって、その発現が抑制されていることがわかりました。NeuroD1は、このバイバレント領域に結合することで、通常はミクログリアで発現が抑制されているニューロン特異的遺伝子の発現上昇を強制的に引き起こしていることがわかりました。さらに、この発現上昇した遺伝子の中に含まれる因子(Kdm6b)は、バイバレント領域の遺伝子発現を負に調節するヒストン修飾だけを消去することで、結果として遺伝子発現を正に調節するヒストン修飾が優位となり、ニューロン特異的遺伝子の発現が恒常的に ONになると考えられました。一方、ミクログリア特異的遺伝子の発現は、NeuroD1の働きによってKdm6bと並行して発現上昇する転写因子(Scrt1 と Meis2)によって抑制されるとともに、エピジェネティクスの書き換えが起こることで、ミクログリア特異的遺伝子の発現が恒常的にOFFになることがわかりました。このように細胞の運命制御に関わるエピジェネティック目印の書き換えが起こり、結果としてニューロンへのダイレクトリプログラミングが誘導されることを明らかにしました(図 5)。
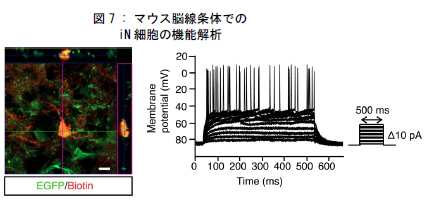
最後に、脳内に存在するミクログリアもニューロンへとダイレクトリプログラミング可能であるのかどうかを検証するため、レンチウイルス*3)を用いて、脳の線条体*4)のミクログリアにNeuroD1を強制発現させました。その結果、培養皿と同じ様にiN細胞へと変化しました(図 6)。作製したニューロンは、既存のニューロンとシナプスを形成することで神経回路に組み込まれ、自発的な神経活動を行いました(図 7)。以上の結果から、iN細胞の作製は生体においても可能であり、作製された細胞は実際のニューロンと同様の性質を示すことがわかりました。
■効果・今後の展開
本研究の成果で、ミクログリアからニューロンへのダイレクトリプログラミングが可能であること、さらにその詳細なメカニズムが明らかになりました。今後は、損傷部位に集積したミクログリアからニューロンへのダイレクトリプログラミングとそれに伴う運動機能回復を評価することで、将来的な神経疾患治療への応用へとつないでいきたいと思っています。
 |
 |
 |
| 図 3 の説明 | |
| Pearsonの相関係数により遺伝子発現の類似性を調べた。ミクログリアにNeuroD1(ND1) を強制発現させてから7 日後(Microglia+ND1 7day : iN 細胞)の遺伝子発現は、実際のニューロン(Neuron)の遺伝子発現と類似している。 | |
| 図 4 の説明 | |
| 各サンプルの遺伝子発現の変化を示すヒートマップ。ミクログリアにND1を強制発現させて2日後(M+ND1 day2) から 7日後(M+ND1 day7)にかけて、ニューロン特異的遺伝子の発現上昇と、ミクログリア特異的遺伝子の発現低下が起こっている。 | |
| 図 5 の説明 | |
| ミクログリアからiN細胞への転換過程のメカニズムを詳細に示した模式図。 | |
| 図 6 の説明 | |
| マウス脳の線条体のミクログリアにND1を強制発現させる(図下、EGFP陽性細胞)と、線条体のニューロン特異的なマーカーであるDARPP32を発現する、線条体ニューロン様細胞へと転換する。コントロール実験ではこのような細胞は認められない(図上、EGFP陽性細胞)。 | |
| 図 7 の説明 | |
| パッチクランプ法を用いた線条体iN細胞(図左)の細胞膜電流測定(図右)を実施すると、iN細胞は神経活動を行っていることがわかった。 | |
【用語解説】
*1)次世代シーケンサー:DNA塩基配列を高速に読み出せる装置。網羅的遺伝子発現解析やエピジェネティクス解析に使用する。
*2)バイバレント状態:遺伝子発現を正に調節するエピジェネティクス目印と、負に調節するエピジェネティクス目印の両方が同時に存在する状態。遺伝子発現自体は抑制されている。
*3)レンチウイルス:自己複製(ウイルス粒子)能力を欠いた遺伝子組み換えレンチウィルス粒子。非分裂細胞を含むほぼ全ての哺乳動物細胞やモデル動物全体に遺伝子を導入し定常発現させるうえで最も効果的な媒体の1つ。
*4)線条体:脳領域の1つ。成体脳において、この領域では、通常新しいニューロンはほとんど産生されない。
【論文情報】Pioneer factor NeuroD1 rearranges transcriptional and epigenetic profiles to execute microglia-neuron conversion.
Taito Matsuda*, Takashi Irie, Shutaro Katsurabayashi#, Yoshinori Hayashi#, Tatsuya Nagai, Nobuhiko Hamazaki, Aliya Mari D Adefuin, Fumihito Miura, Takashi Ito, Hiroshi Kimura, Katsuhiko Shirahige, Tadayuki Takeda, Katsunori Iwasaki, Takuya Imamura and Kinichi Nakashima* (*共責任著者、#等貢献著者)
Neuron, 2019, Doi: 10.1016/j.neuron.2018.12.010

