2023.06.20
「内⽪−造⾎転換の新規メカニズムを解明 」(系統解剖学分野 佐藤 有紀 准教授)
内⽪−造⾎転換の新規メカニズムを解明
⽔チャネル分⼦が促進する液胞形成が鍵
⽔チャネル分⼦が促進する液胞形成が鍵
ポイント
- ① ⾎管内⽪細胞から造⾎幹細胞を⽣み出すしくみの⼀端が明らかに
- ② ⽔チャネル分⼦アクアポリンが内⽪−造⾎転換に関与することを初めて証明
- ③ 細胞⽣理・機械刺激受容の観点からの造⾎発⽣メカニズム解明へ期待
概要
造⾎幹細胞は、胚発⽣期に⾎管内⽪細胞群の⼀部が分化転換することによって⽣み出されます。 この現象は「内⽪−造⾎転換」と呼ばれます。内⽪−造⾎転換は、胚性造⾎と成体型造⾎(⾻髄造 ⾎)を直接的に繋ぐ重要な分化転換現象です。内⽪−造⾎転換の際、扁平な⾎管内⽪細胞から球状 の造⾎幹細胞への劇的な形態変化がおこります。従来の内⽪−造⾎転換に関する研究は、遺伝⼦発 現制御メカニズムの解明が先⾏する⼀⽅で、形態変化に関してはどのようなしくみが働いているの か未解明でした。
九州⼤学⼤学院医学研究院の佐藤有紀准教授らの研究グループは、⽔チャネル分⼦アクアポリン (AQP)を介した⽔分⼦の流⼊が内⽪細胞内の液胞形成を促進し、その結果、細胞の球状化が⽣じる ことを明らかにしました。この発⾒により、内⽪−造⾎転換の際の細胞形態制御メカニズムが初め て解明されました。
液胞形成の役割は植物細胞でよく知られていますが、動物細胞での役割はあまり知られていませ ん。我々の研究から、動物細胞において液胞が細胞の分化転換現象に関わることが判明しました。 今後、この液胞の機能を詳細に解析することで、従来とは異なる⾓度からの内⽪−造⾎転換現象の 理解が進むことが期待されます。
本研究成果は国際学術誌「Development」に2023 年6 ⽉5 ⽇(⽉)に掲載されました。
【研究の背景と経緯】
造⾎幹細胞は⾻髄で維持されることが知られていますが、これらの造⾎幹細胞は胚発⽣期に⾎管内⽪ 細胞からの分化転換(内⽪−造⾎転換)により⽣み出されます。内⽪−造⾎転換によって⾎管から新た に⽣まれた造⾎幹細胞群は⾎液中に放出されて⾎流循環した後、肝臓で⼀時的に蓄えられ、⾻形成期に ⾻髄へと⾎⾏性移動します。内⽪−造⾎転換を起こす造⾎性⾎管内⽪細胞(※1)はもともと扁平な形態 ですが、造⾎幹細胞へと転換する際に球状の形態へと変化し、⾎管から切り離されます。このような造 ⾎性⾎管内⽪細胞の形態変化は、造⾎幹細胞の⾎⾏性移動にとって重要なステップですが、これまでど のようなしくみで扁平な状態から球状へと変化するのかは不明でした。本研究では造⾎⽣⾎管内⽪細胞 内に⼀過的に形成される液胞(※2)に着⽬し、この形成メカニズムを解明することでこの謎に迫りまし た。
造⾎幹細胞は⾻髄で維持されることが知られていますが、これらの造⾎幹細胞は胚発⽣期に⾎管内⽪ 細胞からの分化転換(内⽪−造⾎転換)により⽣み出されます。内⽪−造⾎転換によって⾎管から新た に⽣まれた造⾎幹細胞群は⾎液中に放出されて⾎流循環した後、肝臓で⼀時的に蓄えられ、⾻形成期に ⾻髄へと⾎⾏性移動します。内⽪−造⾎転換を起こす造⾎性⾎管内⽪細胞(※1)はもともと扁平な形態 ですが、造⾎幹細胞へと転換する際に球状の形態へと変化し、⾎管から切り離されます。このような造 ⾎性⾎管内⽪細胞の形態変化は、造⾎幹細胞の⾎⾏性移動にとって重要なステップですが、これまでど のようなしくみで扁平な状態から球状へと変化するのかは不明でした。本研究では造⾎⽣⾎管内⽪細胞 内に⼀過的に形成される液胞(※2)に着⽬し、この形成メカニズムを解明することでこの謎に迫りまし た。
【研究の内容と成果】
植物細胞において⽔チャネル アクアポリン(AQP)は液胞形成に関わることが知られています。造⾎性 ⾎管内⽪細胞においても同様にAQP が液胞形成にかかわるかどうかを検証するため、AQP1 の局在を 調べたところ、AQP1 が造⾎性⾎管内⽪細胞の細胞膜と液胞膜の両⽅に局在することがわかりました(図 1)。この観察結果をもとにAQP1 を介して造⾎幹細胞内の液胞内へ⽔分⼦か流⼊することで球状化が 促進されると予想し、この仮説を検証しました。 AQP1 を過剰発現させると、本来は内⽪−造⾎転換を起こさない⾎管内⽪細胞が液胞を形成して球状 化し、最終的に⾎流中へ放出されることが判明しました。⼀⽅、⽔分⼦の透過性制御に関わるアミノ酸 変異をもつAQP1(R196H)を過剰発現させた場合、液胞形成も球状化も起こりませんでした。このこと から、⽔分⼦の流⼊によって促進される液胞形成が、内⽪−造⾎転換の要因である可能性が⽰唆されま した。 実際にAQP1 が内⽪−造⾎転換に必要かどうかを検証するため、CRISPR/Cas9 ゲノム編集技術を⽤ いてAQP1 遺伝⼦に機能⽋失変異を導⼊しました。ところが予想に反してAQP1 の機能を⽋失させた細 胞は内⽪−造⾎転換をおこしました。AQP 遺伝⼦は、脊椎動物の進化過程で起こった全ゲノム重複によ って、⽔チャネルとしての機能を複数の遺伝⼦群で補佐しあう遺伝⼦ファミリーを構成しています。造 ⾎性⾎管内⽪細胞では、AQP1 に加えてAQP5、AQP8、AQP9 も発現しているため、これらのAQP が 共同で⽔分⼦の取り込みに関わる可能性が考えられました。そこで、AQP1、AQP5、AQP8、AQP9 の4 つの遺伝⼦群についてゲノム編集を⾏い、多重機能⽋失変異を導⼊したところ、造⾎性⾎管内⽪細胞内 の液胞形成不全が起き、球状化が抑制されました。この結果は、造⾎性⾎管内⽪細胞を球状化させるた めには、複数のAQP ⽔チャネルを介して液胞内へ多量の⽔分⼦を蓄積させることが重要である可能性 を⽰唆しています。 以上の研究から、内⽪−造⾎転換の際に働く細胞形態制御メカニズムが初めて明らかになりました (図2)。
植物細胞において⽔チャネル アクアポリン(AQP)は液胞形成に関わることが知られています。造⾎性 ⾎管内⽪細胞においても同様にAQP が液胞形成にかかわるかどうかを検証するため、AQP1 の局在を 調べたところ、AQP1 が造⾎性⾎管内⽪細胞の細胞膜と液胞膜の両⽅に局在することがわかりました(図 1)。この観察結果をもとにAQP1 を介して造⾎幹細胞内の液胞内へ⽔分⼦か流⼊することで球状化が 促進されると予想し、この仮説を検証しました。 AQP1 を過剰発現させると、本来は内⽪−造⾎転換を起こさない⾎管内⽪細胞が液胞を形成して球状 化し、最終的に⾎流中へ放出されることが判明しました。⼀⽅、⽔分⼦の透過性制御に関わるアミノ酸 変異をもつAQP1(R196H)を過剰発現させた場合、液胞形成も球状化も起こりませんでした。このこと から、⽔分⼦の流⼊によって促進される液胞形成が、内⽪−造⾎転換の要因である可能性が⽰唆されま した。 実際にAQP1 が内⽪−造⾎転換に必要かどうかを検証するため、CRISPR/Cas9 ゲノム編集技術を⽤ いてAQP1 遺伝⼦に機能⽋失変異を導⼊しました。ところが予想に反してAQP1 の機能を⽋失させた細 胞は内⽪−造⾎転換をおこしました。AQP 遺伝⼦は、脊椎動物の進化過程で起こった全ゲノム重複によ って、⽔チャネルとしての機能を複数の遺伝⼦群で補佐しあう遺伝⼦ファミリーを構成しています。造 ⾎性⾎管内⽪細胞では、AQP1 に加えてAQP5、AQP8、AQP9 も発現しているため、これらのAQP が 共同で⽔分⼦の取り込みに関わる可能性が考えられました。そこで、AQP1、AQP5、AQP8、AQP9 の4 つの遺伝⼦群についてゲノム編集を⾏い、多重機能⽋失変異を導⼊したところ、造⾎性⾎管内⽪細胞内 の液胞形成不全が起き、球状化が抑制されました。この結果は、造⾎性⾎管内⽪細胞を球状化させるた めには、複数のAQP ⽔チャネルを介して液胞内へ多量の⽔分⼦を蓄積させることが重要である可能性 を⽰唆しています。 以上の研究から、内⽪−造⾎転換の際に働く細胞形態制御メカニズムが初めて明らかになりました (図2)。
【今後の展開】
⽔チャネルAQP の関与は、これまでの造⾎発⽣研究では全く予想されていませんでした。今後、造 ⾎性⾎管内⽪細胞における⽔チャネル開⼝制御機構を解明し、より詳細な分⼦機序の理解を進める必要 があります。また、⽔流⼊によって造⾎性⾎管内⽪細胞内にどのような分⼦的変化が起こるのか(⽔流 ⼊に対する細胞応答)についても、詳細にしていく必要があります。本研究成果を⾜がかりとして、細 胞⽣理や機械刺激応答の観点から、造⾎発⽣現象のさらなる理解が進むことが期待されます。
⽔チャネルAQP の関与は、これまでの造⾎発⽣研究では全く予想されていませんでした。今後、造 ⾎性⾎管内⽪細胞における⽔チャネル開⼝制御機構を解明し、より詳細な分⼦機序の理解を進める必要 があります。また、⽔流⼊によって造⾎性⾎管内⽪細胞内にどのような分⼦的変化が起こるのか(⽔流 ⼊に対する細胞応答)についても、詳細にしていく必要があります。本研究成果を⾜がかりとして、細 胞⽣理や機械刺激応答の観点から、造⾎発⽣現象のさらなる理解が進むことが期待されます。
【参考図】
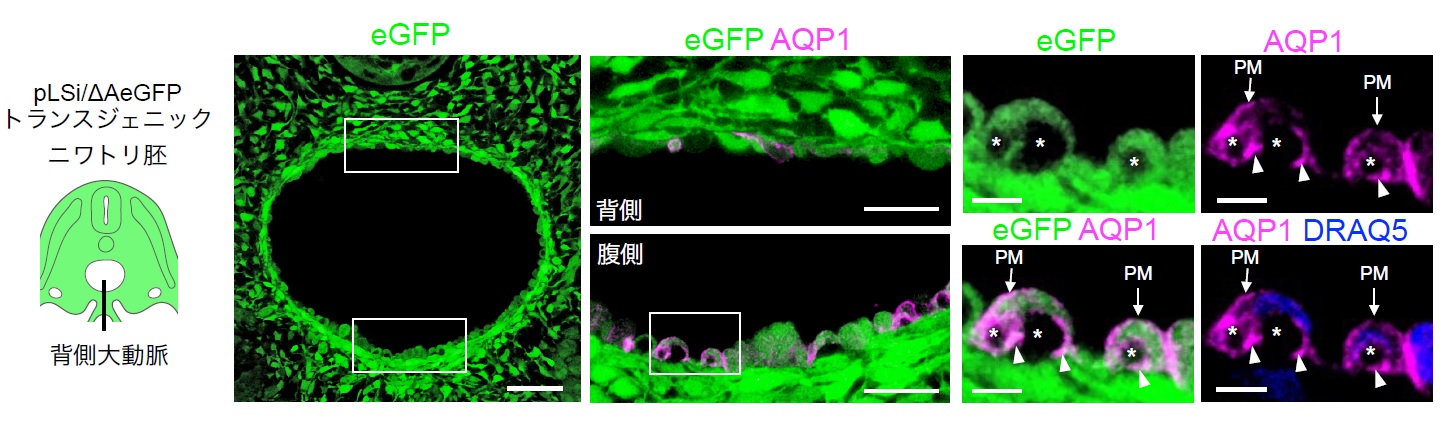
図1 造⾎性⾎管内⽪細胞の細胞膜と液胞膜に局在する⽔チャネル AQP1
背側⼤動脈(※3)の腹側部を構成する⾎管内⽪細胞が内⽪−造⾎転換をおこす。これらの造⾎性⾎管内⽪細胞は液胞(*印:緑⾊蛍光タンパク質eGFP 陰性の領域)を有する。AQP1は造⾎性⾎管内⽪細胞の細胞膜(PM)と液胞膜(⽮頭)に局在する。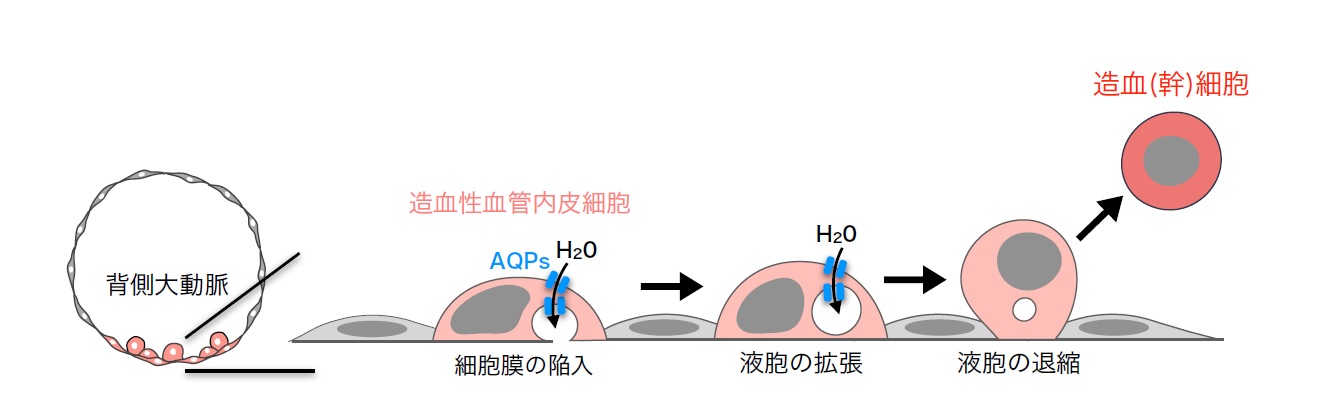
図2 造⾎性⾎管内⽪細胞の球状化メカニズム
造⾎性⾎管内⽪細胞は複数のAQP を介して⽔分⼦を取り込むことで液胞を拡張して球状化する。球状化の過程で造⾎幹細胞(もしくは造⾎細胞)に分化転換し、⾎管壁から遊離して⾎流循環する。【⽤語解説】
(※1) 造⾎性⾎管内⽪細胞
造⾎幹細胞に分化転換する前の⾎管内⽪細胞。通常の⾎管内⽪細胞とは異なり、転写因⼦Runx1 を発現する。造⾎性⾎管内⽪細胞は、特定の発⽣段階において背側⼤動脈の腹側領域に限定して出現する。
(※2) 液胞
脂質⼆重膜で区画された細胞内⼩器官。植物では浸透圧調整や貯蔵庫としての役割を担うことが知られている。電⼦顕微鏡での観察では、電⼦密度が低く内容物がほとんどない空胞としてオートファゴソームやリソソームと区別できる。光学顕微鏡での観察では、蛍光レポーターを取り込まない性質を利⽤して液胞を同定することが可能。
(※3)背側⼤動脈
発⽣中の胚の正中線に沿って形成される最も太い⾎管。出⽣後の名称は⼤動脈。
(※1) 造⾎性⾎管内⽪細胞
造⾎幹細胞に分化転換する前の⾎管内⽪細胞。通常の⾎管内⽪細胞とは異なり、転写因⼦Runx1 を発現する。造⾎性⾎管内⽪細胞は、特定の発⽣段階において背側⼤動脈の腹側領域に限定して出現する。
(※2) 液胞
脂質⼆重膜で区画された細胞内⼩器官。植物では浸透圧調整や貯蔵庫としての役割を担うことが知られている。電⼦顕微鏡での観察では、電⼦密度が低く内容物がほとんどない空胞としてオートファゴソームやリソソームと区別できる。光学顕微鏡での観察では、蛍光レポーターを取り込まない性質を利⽤して液胞を同定することが可能。
(※3)背側⼤動脈
発⽣中の胚の正中線に沿って形成される最も太い⾎管。出⽣後の名称は⼤動脈。
【謝辞】
本研究はJSPS 科研費 (JP16K14739, JP19K06692, and JP20H05332)、クリタ⽔・環境科学振興財団、武⽥科学振興財団(以上、研究代表者 佐藤有紀)、JSPS 科研費(JP16H06280)(研究代表者 坂本浩隆)からの助成、および先端バイオイメージング⽀援(ABiS)、ナショナルバイオリソースプロジェクト(ニワトリ・ウズラ)の⽀援を受けて実施されました。
本研究はJSPS 科研費 (JP16K14739, JP19K06692, and JP20H05332)、クリタ⽔・環境科学振興財団、武⽥科学振興財団(以上、研究代表者 佐藤有紀)、JSPS 科研費(JP16H06280)(研究代表者 坂本浩隆)からの助成、および先端バイオイメージング⽀援(ABiS)、ナショナルバイオリソースプロジェクト(ニワトリ・ウズラ)の⽀援を受けて実施されました。
【論⽂情報】
掲載誌:Development
タイトル:Aquaporin regulates cell rounding through vacuole formation during endothelial-tohematopoietic
transition
著者名:Yuki Sato, Mugiho Shigematsu, Maria Shibata-Kanno, Sho Maejima, Chie Tamura, and
Hirotaka Sakamoto
D O I :10.1242/dev.201275
掲載誌:Development
タイトル:Aquaporin regulates cell rounding through vacuole formation during endothelial-tohematopoietic
transition
著者名:Yuki Sato, Mugiho Shigematsu, Maria Shibata-Kanno, Sho Maejima, Chie Tamura, and
Hirotaka Sakamoto
D O I :10.1242/dev.201275
【お問い合わせ先】
九州⼤学⼤学院医学研究院 系統解剖学分野 准教授 佐藤 有紀(サトウ ユキ)
TEL:092-642-4857 FAX:092-642-6923
Mail: sato.yuki.299★m.kyushu-u.ac.jp
※★→@に置き換えてメールをご送信ください。
九州⼤学⼤学院医学研究院 系統解剖学分野 准教授 佐藤 有紀(サトウ ユキ)
TEL:092-642-4857 FAX:092-642-6923
Mail: sato.yuki.299★m.kyushu-u.ac.jp
※★→@に置き換えてメールをご送信ください。

