2023.07.25
「典型的なミトコンドリア病の症状を軽減するハプロタイプを解明」(保健学部⾨ 検査技術科学 内海 健 教授)
~発症メカニズムの解明や治療薬開発に期待~
- ① ミトコンドリアDNA変異によるミトコンドリア病は心臓、骨格筋、神経系などで重篤な症状を引き起こす母系遺伝性疾患であり、有効な治療法は確立していません。
- ② 本研究では、ミトコンドリアtRNAの遺伝子内部にもつ病原性変異に加えてもう1つの特定の非病原性変異を生まれつきもつとき、ミトコンドリア病で低下がみられるtRNAのタウリン修飾が是正され、ミトコンドリア機能が改善することを世界で初めて明らかにしました。
- ③ これらの成果はミトコンドリア病を発症するメカニズムの理解や、tRNAを対象とした新規治療薬の開発につながることが期待されます。
概要
ミトコンドリア病は、細胞内でエネルギー産生の役割を担うミトコンドリアの機能が低下することで発症します。心臓、骨格筋、神経系などの様々な症状を引き起こす遺伝性疾患で、治療法や治療薬の開発が望まれています。
本研究では、ミトコンドリア病のMELAS(※1)で頻繁に報告されているtRNA(※2)遺伝子内部の病原性変異(3243A>G)(※3)をもつ際に、近くに位置するもう1つの非病原性変異(3290T>C)(※4)がミトコンドリア機能の改善に貢献するという新たな仕組みを解明しました。
九州大学医学系学府博士課程上田沙央理氏、大学院医学研究院臨床検査医学の康東天名誉教授、保健学部門検査技術科学の内海健教授らの研究グループは、東京大学工学系研究科化学生命工学の鈴木勉教授らの研究グループと共同でサイブリッド細胞を構築し、ミトコンドリア機能とミトコンドリアtRNAの解析を行いました。tRNA 遺伝子内部に3243A>G変異と3290T>Cハプロタイプの2つをもつとき、tRNAのタウリン修飾(※5)が改良することでミトコンドリア機能が改善することを明らかにしました。
今回の発見は、ミトコンドリア病の発症メカニズムの解明やtRNAを標的とした新規治療法の開発などに貢献することが期待されます。
本研究成果は国際学術誌「Nucleic Acids Research」に2023年7月13日に掲載されました。
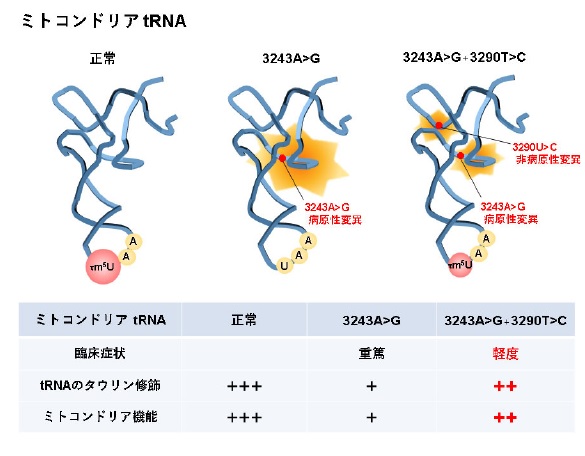
ミトコンドリアtRNAに3243A>G変異をもつとき、tRNAのタウリン修飾が低下することでミトコンドリア機能が低下する。3243A>G変異に加えてハプロタイプ3290T>Cが存在すると、tRNAのタウリン修飾に改良がみられる。その結果、ミトコンドリア機能が改善することで臨床症状は軽度となる。
ミトコンドリアは、細胞内でエネルギー産生の役割を担う細胞小器官です。細胞内の核やミトコンドリアがもつDNAのうちミトコンドリア機能に関わる遺伝子で変異が生じると、心臓、骨格筋、神経系などで様々な症状を呈するミトコンドリア病を発症します。ミトコンドリア病の発症頻度は10万人に9~16人程度で、現在までに有効な治療法は確立していません。なかでも最も発症頻度の高いミトコンドリア脳筋症の一つMELASでは、脳卒中様発作を中心とした重篤な症状が引き起こされ、発症後数年で多くの方が亡くなっています。MELASをはじめとするミトコンドリア病は厚生労働省による指定難病の対象となっており、治療法の開発が望まれています。
MELASを発症する多くの場合では、ミトコンドリアDNAのうちtRNAをコードする遺伝子に変異が生じています。MELASを発症するメカニズムは解明されていませんが、アミノ酸の一種であるタウリンによるtRNAの修飾が関与していると報告されています。MELASの患者では、tRNAの構造が不安定になることでtRNAのタウリン修飾が低下します。その結果、ミトコンドリア機能が低下することを本研究グループの鈴木勉教授が既に報告しています。しかし、ミトコンドリア機能の低下に関わる詳細なメカニズムは未だ解明されていません。
当研究室では、MELASで頻繁に報告されている遺伝子変異であるミトコンドリアDNA 3243A>Gを高い割合でもつにも関わらず、軽度の臨床症状を呈する患者の共通点を見出しました。この発見はMELASの治療やメカニズムの解明に役立つと考え、研究を進めてきました。
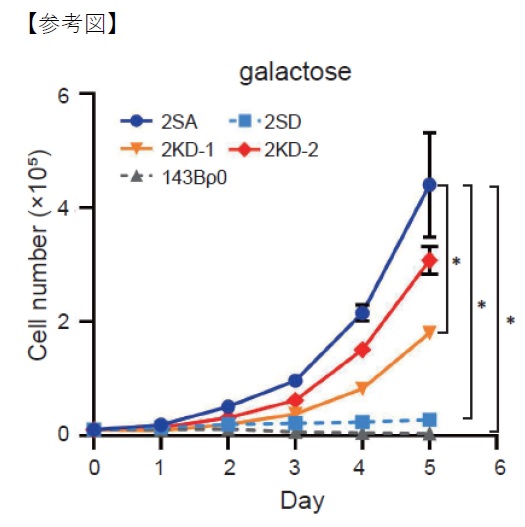
ミトコンドリアDNAの解析結果から、軽度の臨床症状を示す患者にはtRNAの遺伝子内部に病原性変異3243A>Gに加えてもう1つの非病原性変異3290T>Cが共通して存在することを見出しました。そこで、ミトコンドリア機能を評価するために培養細胞を用いた解析を行ったところ、3243A>G と3290T>C の2つの変異をもつ細胞(2KD)は3243A>G のみをもつ細胞(2SD)と比較して、ミトコンドリア依存的にエネルギーを産生して増殖できることが分かりました(図1)。そして、ミトコンドリア機能障害の程度を示すマーカーの遺伝子発現を調べたところ、3243A>Gと3290T>Cをもつ細胞(2KD)では3243A>Gのみをもつ細胞(2SD)ほどの障害が起きていないことが分かりました。また、tRNAのタウリン修飾を調べたところ、3243A>Gと3290T>Cをもつ細胞(2KD)では3243A>Gのみをもつ細胞(2SD)よりもタウリン修飾が改善していることが分かりました。したがって、3243A>Gと3290T>Cをもつ細胞(2KD)ではtRNAのタウリン修飾の改善に伴い、ミトコンドリア機能が改善していることが今回の研究で明らかになりました。
今回の研究では、tRNAの遺伝子内部に病原性変異に加えてもう1つの特定のハプロタイプをもつとき、tRNAのタウリン修飾やミトコンドリア機能が改善することを確認し、臨床症状も比較的軽度であることを世界で初めて報告しました。このハプロタイプにはtRNAの構造を安定化させる働きがあると考えられますが、ミトコンドリア機能の改善に関与するメカニズムを解明することで、MELASをはじめとしたミトコンドリア病の新規治療薬の開発に貢献できる可能性があると考えています。
本研究は、当院の検査部で実施しているミトコンドリア遺伝子検査がきっかけで始められました。多くの臨床科の先生(井出先生、森先生、大山先生)からのご紹介により見つけられた貴重なハプロタイプの症例でした。また、博士課程大学院生の上田さん(筆頭著者)が臨床検査技師として働きながら解析を進めてきました。
(※1) MELAS
ミトコンドリア脳筋症・乳酸アシドーシス・脳卒中様発作症候群の略。脳卒中様症状を中心に、全身の様々な臓器で多様な症状を呈することが特徴である。
(※2) tRNA
転移RNA(トランスファーRNA)の略で、遺伝情報を読み取り、その情報に従ってアミノ酸を運ぶ分子である。
(※3) 3243A>G
ミトコンドリアDNA上の塩基番号3243が、A(アデニン)からG(グアニン)に変異していることを示す。MELAS患者の8割以上で、この3243A>G変異がみられる。
(※4) 3290T>C
ミトコンドリアDNA上の塩基番号3290が、T(チミン)からC(シトシン)に変異していることを示す。この変異は東南アジアに多く、遺伝的に連鎖している塩基置換の組み合わせ(ハプロタイプ)で共通してみられる。
(※5) タウリン修飾
tRNAの遺伝情報を読み取る部分に、アミノ酸であるタウリンが結合していること。タウリン修飾はtRNAの正確な遺伝情報の読み取りに関与している。
本研究はJSPS科研費(20H00530, 21K11678, 22H03537, 21H04278)、ERATO科研費(JPMJER2002)の助成を受けたものです。
掲載誌:Nucleic Acids Research
タイトル:Mitochondrial haplotype mutation alleviates respiratory defect of MELAS by restoring
taurine modification in tRNA with 3243A>G mutation
著者名:Saori Ueda, Mikako Yagi, Ena Tomoda, Shinya Matsumoto, Yasushi Ueyanagi, Yura Do, Daiki
Setoyama, Yuichi Matsushima, Asuteka Nagao, Tsutomu Suzuki, Tomomi Ide, Yusuke Mori, Noriko
Oyama, Dongchon Kang, and Takeshi Uchiumi
DOI: 10.1093/nar/gkad591
保健学部⾨ 検査技術科 教授 内海 健(ウチウミ タケシ)
TEL:092-642-6712 FAX:092-642-6712
Mail:uchiumi.takeshi.008★m.kyushu-u.ac.jp
※★→@に置き換えてメールをご送信ください。

